Écriture : Célia Bresson
Relecture scientifique : Elsa Amsellem et Jean Bollard
Relecture de forme : Agathe Goret, Pierre Marrec et Eléonore Pérès
Temps de lecture : environ 11 minutes.
Thématiques : Géochimie & Cosmochimie (Chimie & Géologie)
Publication originale : Ku Y. and Jacobsen S. B., Potassium isotope anomalies in meteorites inherited from the protosolar molecular cloud, Science Advances, 2020. DOI : 10.1126/sciadv.abd0511

La cosmochimie a pour but de comprendre la formation du Système Solaire, en comparant notamment la composition des météorites et des planètes à celle du Soleil. Pourquoi ? Parce qu’il n’a quasi pas évolué depuis le début du Système Solaire. Cette comparaison a mis en lumière un déficit en certains éléments chimiques dans les corps planétaires par rapport à la composition initiale du Système Solaire. D’où vient ce déficit ? L’article présenté ici montre qu’il serait hérité du nuage moléculaire, un ancêtre du Système Solaire.
Qu’y avait-il avant ? Cette question a motivé des générations de chercheurs et de chercheuses dans de nombreux domaines : histoire, archéologie, géologie mais aussi (et c’est ce qui nous intéresse) astrophysique. Qu’y avait-il avant la Terre ? À quoi ressemblait le Système Solaire au début de son existence ? Si nous avons quelques pistes de réponses, l’évolution du Système Solaire reste très mal comprise.
La Figure 1 donne un aperçu de ce que nous pensons être son histoire. Au début, tout n’était que gaz. Sur Terre, de nombreux éléments n’existent pas sous forme de gaz, comme le calcium dans les os ou le fer des barres de métal. Mais dans l’espace, c’est différent ! Tout est généralement si espacé qu’il est très difficile de créer de la matière solide. Sauf dans certaines zones de l’espace, appelées nuages moléculaires (Figure 1, en haut à gauche). Ici, la densité est un peu plus élevée, ce qui aurait permis aux atomes et molécules du gaz de se rapprocher énormément et de se mettre à tourner, jusqu’à former une étoile — notre Soleil — et un disque autour d’elle, appelé le disque protoplanétaire (Figure 1, en bas à gauche). Petit à petit, la température aurait diminué, permettant aux éléments chimiques du gaz de se condenser, c’est-à-dire devenir solides. Pour autant, cela reste une théorie, bien qu’étayée par de nombreux arguments, et il reste de nombreuses inconnues !

Les éléments chimiques sont séparés en de nombreux groupes notamment selon leur température de condensation, c’est-à-dire la température à laquelle ils sont devenus solides lors du refroidissement du Système Solaire au début de son histoire (Figure 1). Les éléments réfractaires, avec une température de condensation élevée, sont les premiers éléments à s’être solidifiés. Puis, ce fut le tour des éléments volatils comme l’oxygène ou l’azote avec une température de condensation basse. Il suffit d’élever un peu la température pour que ces éléments redeviennent gazeux et soient en partie perdus lors de la formation d’une planète. Aujourd’hui, on retrouve très peu de ces éléments dans les météorites — roches d’origine extraterrestre qui s’écrasent sur le sol terrestre — ou les planètes, par rapport à la composition initiale du Système Solaire car ils ont largement eu le temps de s’évaporer. En revanche, ce n’est pas le cas d’autres éléments avec une température de condensation légèrement plus élevée. Ces éléments, les éléments modérément volatils ou EMV, ont pu commencer à s’évaporer sans toutefois disparaître complètement. On peut donc comparer la quantité d’EMV restant dans chaque corps céleste : cela nous donne des indices sur leur histoire !

Malheureusement, on ne peut pas regarder la composition de tous les EMV pour des questions purement techniques. Nos instruments ne sont pas adaptés à leur étude ou fournissent des résultats trop imprécis. Pour étudier la formation du Système Solaire et les processus thermiques qui s’y sont déroulés, il faut donc choisir un EMV approprié. Le potassium (K) est un bon candidat : il est abondant, relativement léger et possède plusieurs isotopes [*] stables, c’est-à-dire qu’il existe plusieurs versions de cet élément selon le nombre de nucléons (protons + neutrons), comme le 39K, qui possède 39 nucléons. Vous connaissez sûrement le potassium car on le côtoie quotidiennement : il est très abondant dans les bananes ou dans le sel de potassium lorsqu’on veut limiter son apport en sodium (sel classique). De récents progrès techniques nous permettent d’analyser sa composition isotopique et de répondre à des questions laissées en suspens depuis des dizaines d’années.
Le potassium possède deux isotopes stables : 39K et 41K. L’isotope 39K est plus léger que l’isotope 41K et a donc tendance à s’évaporer plus facilement. La composition isotopique en potassium est tout simplement le rapport 41K/39K. Les instruments pouvant apporter des biais de mesure dont on veut s’affranchir, ce ratio est alors rapporté à un standard commun à tous les laboratoires, noté ![]() (la lettre grecque delta). La Terre a par exemple une composition isotopique en potassium de -0,48 ‰ [**], ce qui signifie qu’elle est enrichie en isotopes légers (ou appauvrie en isotopes lourds selon le point de vue) par rapport au standard, dont la composition est définie en laboratoire et fixée à 0 ‰ [pour approfondir : voir note A].
(la lettre grecque delta). La Terre a par exemple une composition isotopique en potassium de -0,48 ‰ [**], ce qui signifie qu’elle est enrichie en isotopes légers (ou appauvrie en isotopes lourds selon le point de vue) par rapport au standard, dont la composition est définie en laboratoire et fixée à 0 ‰ [pour approfondir : voir note A].
La publication présentée ici étudie les différences de composition isotopique en potassium de différents corps célestes et tente de comprendre leur origine. Cette composition est unique à chaque corps céleste et chaque type de météorites, puisqu’elle est le reflet d’une histoire propre à chaque objet. C’est également le cas du rapport du calcium sur le potassium (Ca/K), quantifiant la perte totale de potassium. Le calcium (Ca) est un élément réfractaire (Figure 2), c’est-à-dire qu’il faut chauffer extrêmement fort pour le rendre gazeux, contrairement au potassium. Ainsi, dès qu’on chauffe légèrement une planète, celle-ci perdra son potassium, modérément volatil, mais pas son calcium. Plus on va chauffer, plus le rapport Ca/K va augmenter et ce rapport est donc unique à chaque planète. Les chercheurs et chercheuses ont comparé cette composition et ce rapport à celle des météorites CI, le groupe de météorites les plus primitives (CI signifiant Carbonées Ivuna) (Figure 3). Elles correspondent à la composition initiale du Système Solaire car elles possèdent les mêmes éléments en même abondance que le Soleil. On peut donc dire que c’est la composition « de départ » des planètes et astéroïdes.
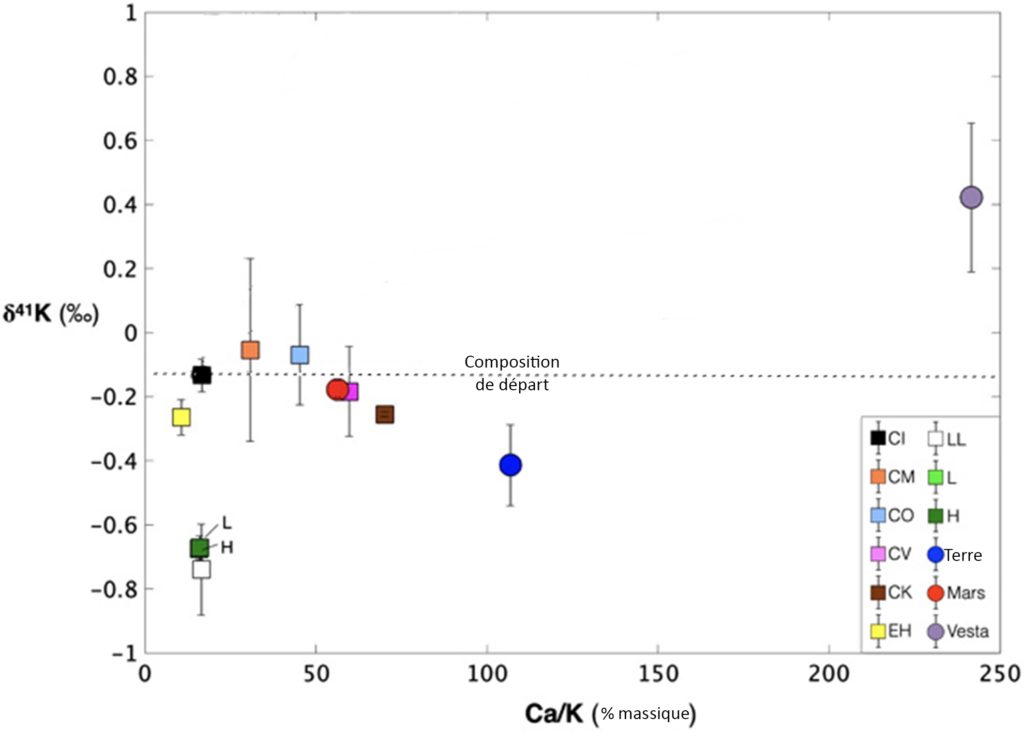
Sur la Figure 3, on remarque que quasiment toutes les météorites et tous les corps planétaires sont appauvris en potassium lourd par rapport à la composition initiale du Système Solaire, puisqu’ils se situent plus bas que les météorites CI (ligne pointillée). Cela veut dire que le 41K s’est préférablement évaporé par rapport au 39K. Ce résultat n’est pas nouveau, et plusieurs mécanismes ont été proposés par les scientifiques au cours du temps pour expliquer cet appauvrissement :
- Lorsque le nuage moléculaire s’est effondré pour former le disque protoplanétaire, (Figure 1, en haut à gauche), il est possible que certains isotopes se soient préférentiellement condensés par rapport à d’autres.
- Durant des collisions entre planètes, la température a probablement été suffisamment élevée pour permettre l’évaporation partielle de certains isotopes.
- Le 41K était peut-être réparti inégalement dans le nuage moléculaire. Il est issu de la désintégration du 41Ca, lui-même créé lors de l’explosion d’une étoile en fin de vie, aussi appelée supernova. La supernova peut avoir éjecté le 41Ca de manière hétérogène, ce qui aurait conduit à l’hétérogénéité du 41K dans le nuage moléculaire.
L’analyse des isotopes du potassium et d’autres éléments devraient justement nous permettre ─ enfin, surtout aux auteurices de la publication ─ de repérer un scénario plus légitime que les autres !
Au départ, le Système Solaire avait une composition isotopique en potassium de -0,133 ‰, comme montré par les météorites CI (Figure 3, carré noir et ligne pointillée). La Terre, avec sa composition de -0,48 ‰, est donc plus légère que la composition initiale du Système Solaire (Figure 3, rond bleu). Cet appauvrissement en isotope lourd se retrouve dans tous les corps planétaires et types de météorites. Or, cela est contradictoire avec un mécanisme d’appauvrissement par condensation partielle (hypothèse 1) ou évaporation (hypothèse 2). En effet, l’évaporation ou la condensation partielle ont tendance à enrichir en isotopes lourds (ou à appauvrir en isotopes légers). Le contraire de ce que les données nous indiquent ! On peut donc écarter ces deux mécanismes. Il ne reste plus que la troisième hypothèse [pour approfondir : voir note B].
Mais cette hypothèse peut elle-même être divisée en trois scénarios principaux ! (Figure 4)
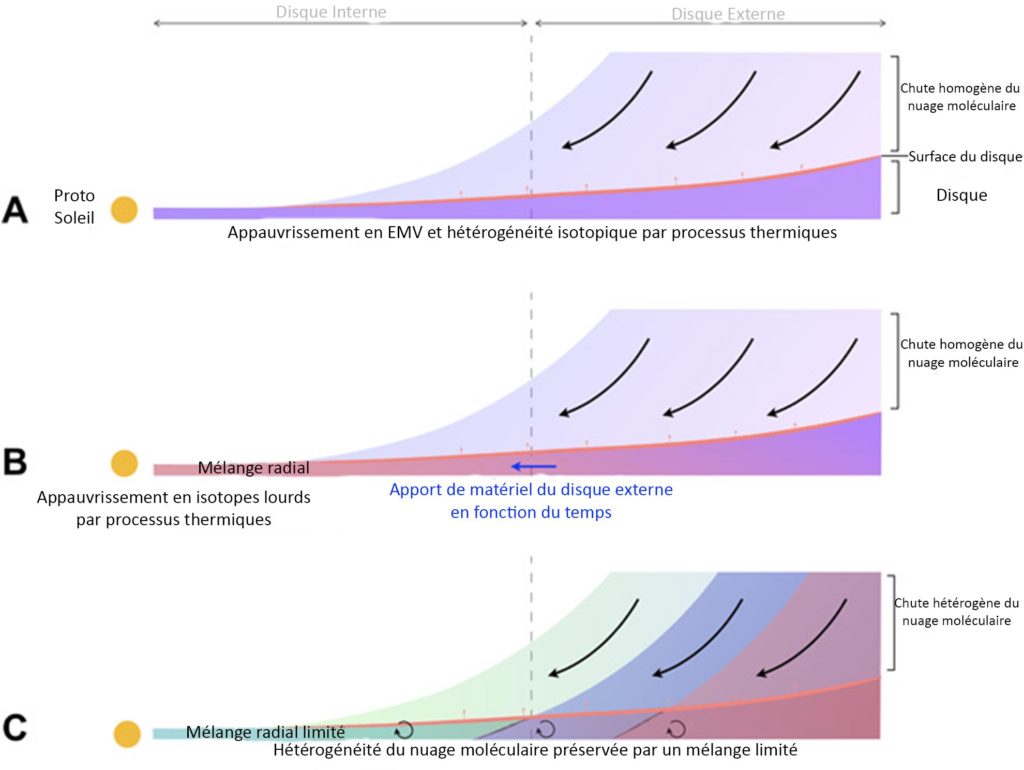
Le premier scénario (Figure 4A) suppose que le nuage moléculaire dépose de la poussière de manière homogène sur l’ensemble du disque protoplanétaire (couleur unie). Celui-ci est chauffé par le Proto Soleil, conduisant à une perte plus grande de 39K à l’intérieur du disque que sur les bords. De la même manière que pour les mécanismes par évaporation/condensation partielle, on devrait observer une corrélation entre appauvrissement en EMV et composition isotopique plus lourde, c’est-à-dire que les points devraient être répartis du bas à gauche vers le haut à droite sur la Figure 3. Mais ce n’est pas le cas, ce scénario est donc exclu.
Le second modèle (Figure 4B) reprend lui aussi un dépôt de poussière homogène du nuage moléculaire chauffé par le Soleil (couleur unie) mais il serait en plus accompagné d’un mélange de l’intérieur vers l’extérieur (dégradé de couleur). La composition des planètes dépendrait alors de leur âge. Ce scénario prédit que la Terre, plus jeune que Mars, devrait être plus enrichie en isotope lourd que cette dernière. En effet, les deux planètes se forment vers l’intérieur du disque, qui est appauvri en potassium lourd comme montré dans le premier scénario. Sauf qu’il y aurait un apport régulier en isotope lourd venant de la partie extérieure du Système Solaire. Mars, formée très vite, n’en aurait pas profité, contrairement à la Terre. Cependant ce n’est pas ce que les données nous montrent, Mars ayant une composition isotopique en potassium de -0,177 ‰ (Figure 3, rond rouge), donc plus lourde que la Terre. Ce scénario est donc encore une fois écarté !
Il ne reste plus qu’un scénario (Figure 4C). Dans celui-ci, c’est le nuage moléculaire de départ qui est hétérogène (3 couleurs différentes). Il y aurait très peu de mélange dans le disque protoplanétaire, ce qui conserverait l’hétérogénéité en isotope 41K (provenant du 41Ca). Ce modèle est compatible avec les données car il ne nécessite pas de corrélation entre appauvrissement en potassium et composition isotopique. De plus, avec cette absence de mélange dans le disque, cela explique également pourquoi les planètes comme Mars et la Terre, pourtant si proche à l’échelle astronomique, ont des compositions si différentes.
Cet article est l’un des premiers à soutenir cette hypothèse d’une hétérogénéité héritée du nuage moléculaire. De nombreuses expériences sont encore à faire afin de valider cette théorie.
Éléments pour approfondir
Note A
Comment obtient-on la composition isotopique d’une météorite ?
La première étape consiste en la dissolution de la météorite. Pour ce faire, on la réduit en poudre puis on la plonge dans un bain d’acide ultra concentré. Mais les météorites, comme toutes les roches, sont très résistantes. Pour dissoudre les derniers minéraux restants, il est nécessaire de faire monter le mélange à haute température et haute pression. Après ce traitement vigoureux, la météorite est totalement dissoute dans l’acide ! On pourrait mesurer la quantité de potassium directement, mais les autres éléments présents dans la météorite peuvent fausser les résultats, cela s’appelle l’effet de matrice. Il est donc nécessaire d’isoler le potassium des autres éléments, c’est-à-dire de le purifier. On utilise pour cela des colonnes de chromatographie. Les colonnes sont des tubes remplis de résine. Cette résine a une affinité plus ou moins grande avec les différents éléments, qui mettront plus ou moins de temps à traverser la colonne (Figure 5).
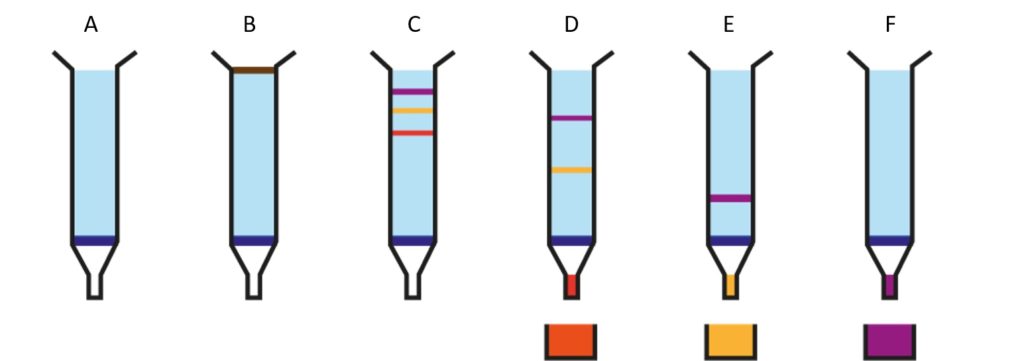
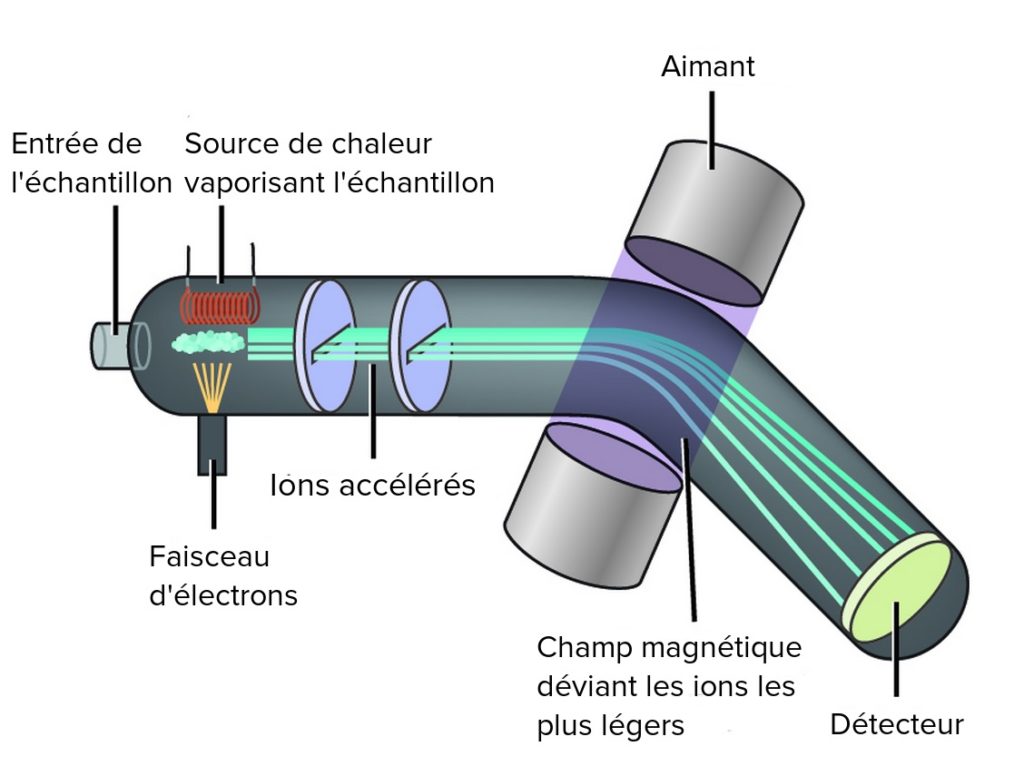
En récupérant la bonne portion de l’échantillon, on peut donc ne récupérer que le potassium. Cette manipulation est à refaire plusieurs fois pour être sûr d’avoir purifié correctement le potassium. Une fois qu’il est isolé, il faut déterminer sa composition isotopique, c’est-à-dire compter les atomes de 39K et 41K. On utilise un spectromètre de masse. Celui-ci permet le passage de l’échantillon sous forme ionique (grâce à une source de chaleur et un faisceau d’électrons), il devient donc sensible au champ magnétique (Figure 6). Les ions sont ensuite accélérés et déviés par un aimant. Les plus lourds sont moins déviés que les plus légers. Ainsi, les ions de masses différentes arrivent à différents endroits du détecteur. Comme le 41K est plus lourd que le 39K, on peut les distinguer !
La composition isotopique de l’échantillon (appelée ![]() ) est donnée par l’équation suivante :
) est donnée par l’équation suivante :
![]()
Il est nécessaire de comparer l’échantillon à un standard (commun à tous les laboratoires), car il est impossible de connaître le biais de l’instrument. Et voilà, nous avons mesuré la composition isotopique d’une météorite (ou de toute autre roche) !
Note B
Une preuve supplémentaire pour le choix du mécanisme
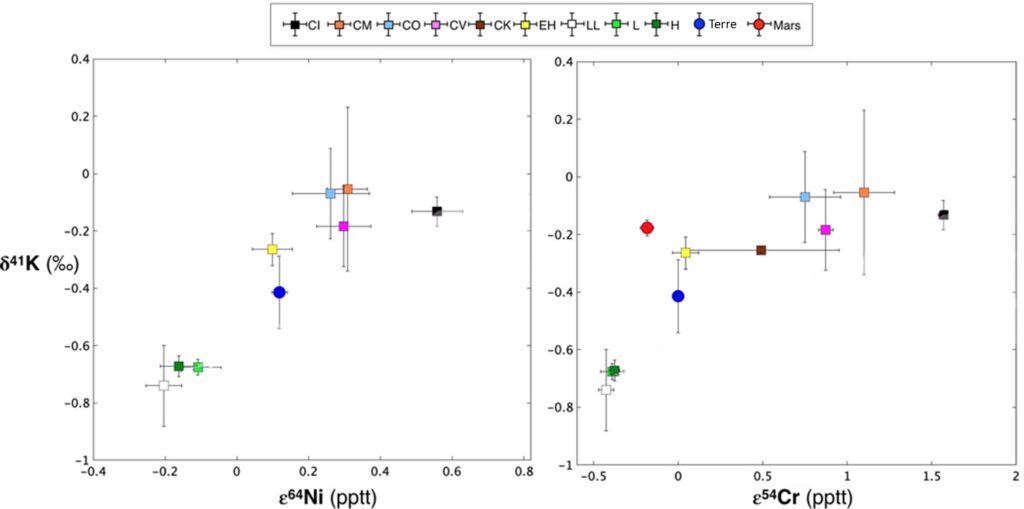
Si l’on regarde la composition isotopique en nickel (Ni) et en chrome (Cr), on s’aperçoit qu’il y a une forte corrélation entre leurs compositions et celle du potassium (Figure 7). Ces compositions isotopiques sont notées avec un ![]() et non un
et non un ![]() , car les écarts au standard sont plus petits. Il faut multiplier
, car les écarts au standard sont plus petits. Il faut multiplier ![]() par 10 pour obtenir
par 10 pour obtenir ![]() . On voit bien ici que lorsque
. On voit bien ici que lorsque ![]() augmente,
augmente, ![]() et
et ![]() augmentent aussi.
augmentent aussi.
 correspond à
correspond à 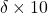 . pptt signifie part per ten thousand (partie par 10 000), 1 pptt = 0,1 ‰ Crédit : issue de la publication originale/CC BY-NC 4.0 et modifiée par l’autrice.
. pptt signifie part per ten thousand (partie par 10 000), 1 pptt = 0,1 ‰ Crédit : issue de la publication originale/CC BY-NC 4.0 et modifiée par l’autrice.Or, le Cr et le Ni sont deux éléments également produits par les supernovæ ! S’ils se comportent de la même manière que le potassium, c’est donc que l’hypothèse d’une hétérogénéité héritée du nuage moléculaire est la bonne.
[*] Isotope : Un élément, défini par son nombre de protons dans son noyau atomique, peut posséder plusieurs isotopes qui varient dans leur nombre de neutrons, autre nucléon constitutif du noyau. On note AX, l’isotope A de l’élément X, qui possède A nucléons.
[**] Le symbole ‰ signifie « pour mille ». 1 ‰ correspond à 0,1 %, c’est-à–dire à 0,001.
[1] Lodders K., Solar System Abundances and Condensation Temperatures of the Elements. Astrophysical Journal, 2003. DOI : 10.1086/375492. [Review]