Chargement de l'article...
Écriture : Eléonore Pérès
Relecture scientifique : Maud Pascal et Aurélien Schwob
Relecture de forme : Agathe Pralus et Jérémy Ferrand
Temps de lecture : environ 12 minutes.
Thématiques : Immunologie (Biologie)
Publication originale : Abdel-Gadir A., et al., Microbiota therapy acts via a regulatory T cell MyD88/RORγt pathway to suppress food allergy. Nature Medecine, 2019. DOI : 10.1038/s41591-019-0461-z
Version libre disponible ici.

Saviez-vous que notre organisme contient au moins autant de bactéries que de cellules humaines ? Alors que l’on commence à peine à entrevoir l’étendue de l’influence du microbiote sur notre santé, son potentiel thérapeutique semble déjà immense. Dans un contexte foisonnant d’explorations de ces propriétés à visée médicale, la publication d’Azza Abdel-Gadir et ses collègues parue en 2019 présente un cocktail de bactéries permettant de protéger des souris d’une allergie alimentaire grave. Comment ? En empêchant une population cellulaire qui prône la tolérance immunitaire de se détourner vers le côté obscur de la Force.
Au marché, vous apercevez sur l’étal de la poissonnerie un magnifique homard. Ni une ni deux, vous vous retroussez les manches et c’est tout à votre joie anticipée que vous le plongez dans la cocotte. Seulement, après quelques bouchées — délicieuses — vous vous sentez soudainement mal. Votre gorge enfle, vous n’arrivez plus à respirer et ça vous gratte de partout. Vous voilà en train de faire un choc anaphylactique, une réaction allergique grave. Vous ne le saviez pas mais vous êtes allergique aux crustacés !
L’allergie est une réaction disproportionnée du système immunitaire face à un élément venu de l’extérieur pourtant inoffensif. Elle est due à une rupture de l’équilibre établi entre deux populations cellulaires immunitaires particulières : les cellules dites de l’immunité de type 2 et les lymphocytes régulateurs.
D’un côté, les cellules de l’immunité de type 2 sont spécialisées dans la défense contre les microorganismes (ou microbes) pathogènes ennemis qui se baladent à l’extérieur de nos cellules, comme des bactéries par exemple. Ce bataillon combattant dispose d’une arme redoutable, les anticorps, qui reconnaissent et se fixent à ces microorganismes ennemis, conduisant à leur neutralisation (Figure 1, gauche). Les lymphocytes régulateurs ont quant à eux un rôle de casques bleus pacificateurs, évitant que le premier bataillon ne tire à l’aveugle sur tout ce qui bouge et offrant une protection aux corps étrangers inoffensifs pour l’organisme (Figure 1, droite). Ces deux entités aux rôles opposés sont d’égale importance, et l’équilibre entre les deux est garant de la bonne santé de l’organisme.
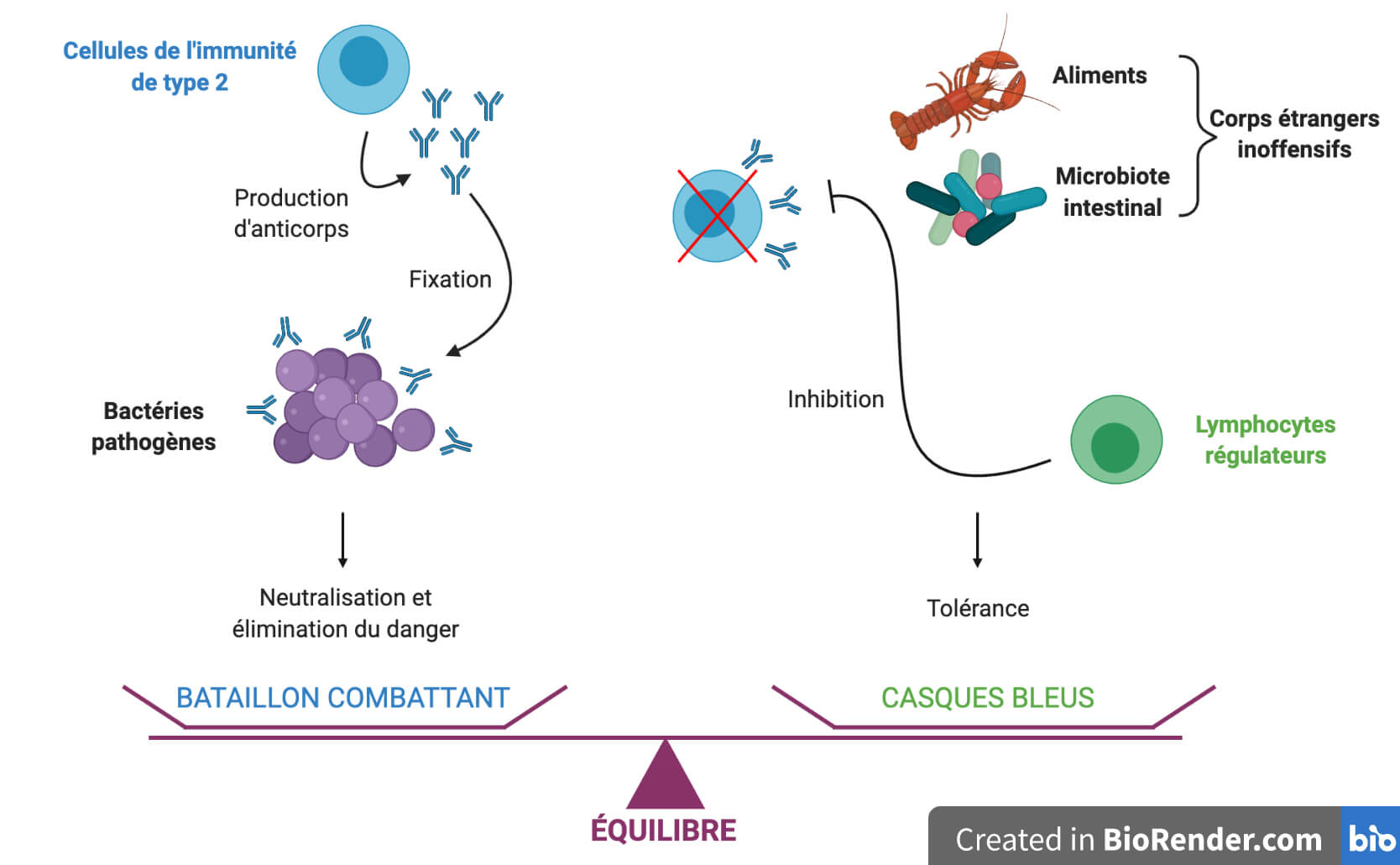
Au niveau de la muqueuse intestinale, le danger est constamment présent car des virus ou bactéries pathogènes peuvent se faufiler parmi les aliments… Pour autant, il y a davantage encore de corps étrangers qui ne sont pas des menaces : les aliments eux-mêmes qui arrivent abondamment à chaque repas, mais aussi tous les microorganismes bénéfiques, majoritairement des bactéries, qui tapissent le système digestif et constituent le microbiote intestinal. La protection des aliments et du microbiote intestinal des attaques inappropriées du système immunitaire s’appelle la tolérance orale (Figure 1, droite).
Concrètement, quand vous avez avalé votre repas à base de homard, cette tolérance s’est rompue. À l’intérieur de votre système digestif, les cellules de l’immunité de type 2 se sont déployées contre un adversaire pourtant inoffensif, un allergène de homard, et ont produit des anticorps anti-homard. Pendant ce temps, les casques bleus régulateurs n’ont pas pu empêcher cette attaque du bataillon combattant. C’est cette réaction qui, propagée à l’ensemble de votre corps, vous a rendu malade. Complètement contre-productif me direz-vous… Eh oui, contre-productif et dangereux.
Vous vous en sortez bien car votre mère, en vacances chez vous et très allergique aux noisettes, avait justement apporté son injecteur d’adrénaline avec elle [*]. Ce traitement d’urgence vous a rapidement remis sur pied. Pour les personnes les plus atteintes qui font des réactions allergiques graves, peu d’alternatives existent. Les traitements préventifs sont fastidieux, très longs et ne fonctionnent pas toujours. C’est pourquoi des équipes de recherche s’intéressent à de nouvelles pistes thérapeutiques.
Le microbiote intestinal est justement l’une de ces cibles potentielles. Il est en effet un facteur clé de notre bonne santé physique et mentale. De nombreuses pathologies sont liées à un déséquilibre entre les différentes espèces de bactéries qui le composent — ce qui est appelé dysbiose. Notamment, des études indiquent depuis plusieurs années qu’une dysbiose serait associée à l’allergie alimentaire chez l’humain et la souris [1, 2]. Mais ce lien est-il direct ? Et si oui, serait-il possible d’éviter l’allergie alimentaire en rééquilibrant le microbiote intestinal ?
Pour des raisons aussi bien éthiques que pratiques, l’équipe d’Azza Abdel-Gadir et de ses collègues a cherché la réponse à ces questions chez la souris, en étudiant les effets d’une transplantation de bactéries dans un modèle de l’allergie alimentaire.
Quand des souris deviennent allergiques aux œufs
Pour en arriver là, il leur fallait d’abord un modèle de souris souffrant de cette allergie. L’équipe a donc choisi de travailler avec une souche de souris génétiquement modifiée pour être sensible aux allergies : on parle d’un « terrain » allergique. À l’aide d’un protocole simple, les chercheuses et chercheurs peuvent ensuite rendre ces souris allergiques à un allergène alimentaire précis. Ici, l’équipe a opté pour l’ovalbumine, une protéine de l’œuf couramment utilisée dans les laboratoires.
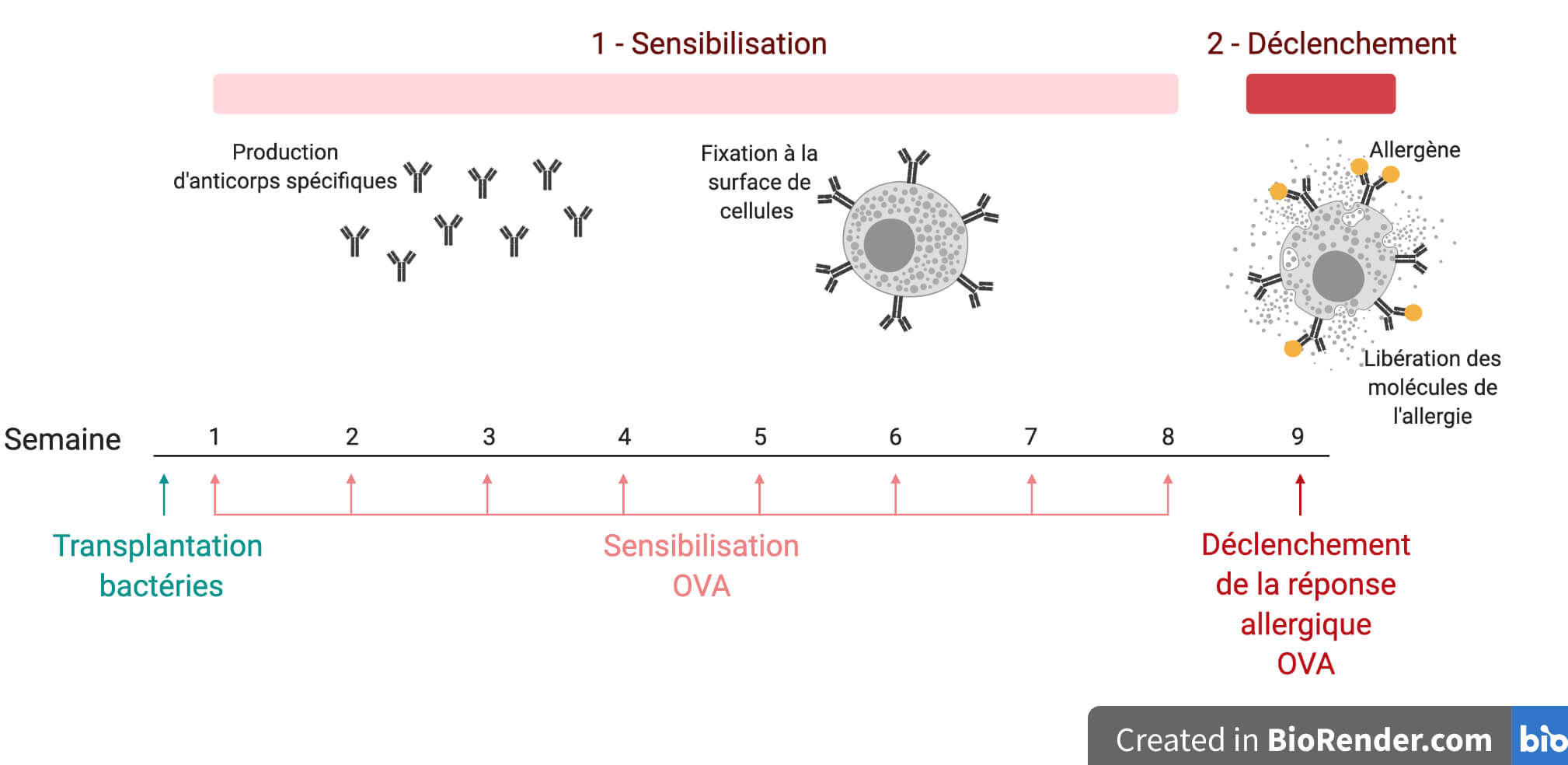
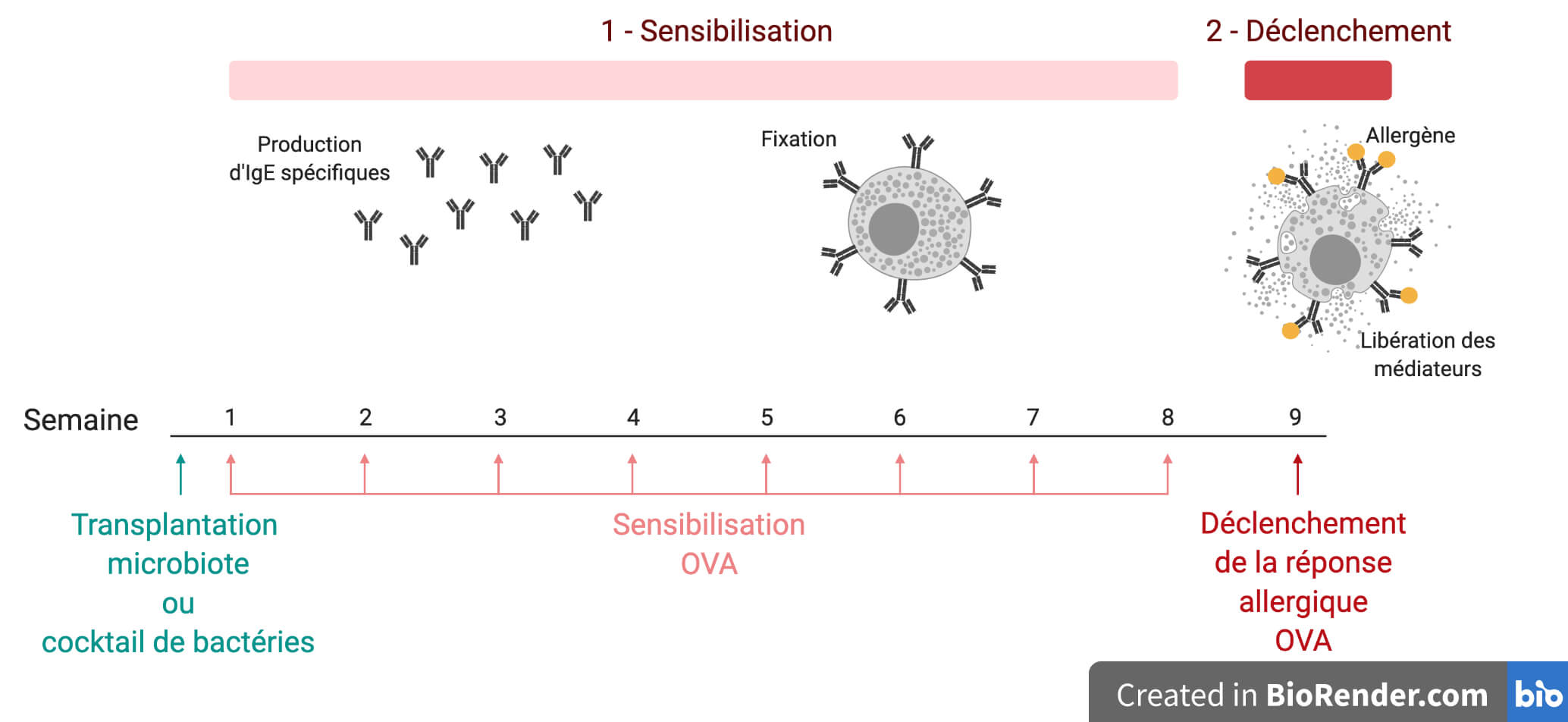
Le protocole se décompose en deux étapes (Figure 2) :
- Une phase de sensibilisation pendant laquelle l’administration répétée — par voie orale — de l’ovalbumine à faible dose induit une réaction immunitaire chez la souris de terrain allergique. Cette réaction immunitaire se caractérise par l’activation d’un type particulier de cellules immunitaires remplies des molécules chimiques responsables de l’allergie. À ce stade, ces molécules sont sagement au chaud à l’intérieur des cellules, donc tout va bien. Par contre, ces cellules se recouvrent progressivement d’anticorps anti-ovalbumine, sortes de radars spécifiques de cet allergène.
- Une phase de déclenchement lors de laquelle la souris ingère une dose environ dix fois plus importante d’ovalbumine. L’ovalbumine est alors reconnue par les anticorps présents à la surface des cellules qui explosent, libérant dans l’organisme les molécules qui induisent toutes les manifestations de la réponse allergique. La souris fait un choc anaphylactique, caractérisé par une forte et rapide diminution de sa température corporelle et par la présence dans le sang d’anticorps anti-ovalbumine.
Si le protocole est réalisé, non plus avec de l’ovalbumine, mais avec une solution sans allergène, alors les souris ne présentent aucun signe d’allergie. Cette condition témoin prouve que c’est bien l’ovalbumine qui est responsable de la réaction allergique observée.
Pour étudier l’effet du microbiote intestinal, on peut le transplanter directement d’un individu à un autre, que ce soit chez l’humain ou la souris. Pour cela, il s’agit de récupérer les selles d’individus sains (oui oui, vous avez bien compris !) puis de les transplanter dans le système digestif de l’individu receveur. Lorsque l’équipe de recherche transplante du microbiote intestinal provenant d’autres souris souffrant de dysbiose avant l’étape de sensibilisation (Figure 2, en vert), nos souris receveuses de terrain allergique font un choc anaphylactique. Par contre, si le microbiote provient de souris donneuses en bonne santé, les souris receveuses n’ont pas de réaction allergique. La seule présence d’un microbiote sain permet donc de prévenir l’allergie alimentaire dans ce modèle [**].
Un smoothie de bactéries et c’est reparti !
Dans cette expérience, la transplantation concerne un microbiote intestinal complet caractérisé par un grand nombre d’espèces et de microorganismes différents (des virus, des bactéries, etc.), dont certains ne sont d’ailleurs pas encore connus. Pour une utilisation thérapeutique ciblée, ce n’est pas forcément le plus pratique. Les scientifiques de cette équipe ont donc confectionné deux cocktails « purs » de bactéries du microbiote intestinal humain. Celles-ci n’ont pas été choisies au hasard. Le premier cocktail contient six espèces de bactéries anormalement moins abondantes dans le microbiote intestinal d’humains souffrant d’allergies alimentaires, tandis que le second comporte cinq autres espèces de bactéries déjà connues pour protéger de certaines pathologies humaines [3].
L’équipe de recherche a alors administré l’une ou l’autre de ces bactériothérapies dans le système digestif des souris, avant de les soumettre au protocole de sensibilisation/déclenchement (Figure 2). Les deux cocktails ont le même résultat : leur transplantation protège les souris de la réaction allergique, elles ne font pas de choc anaphylactique ! Pour observer cette protection, les bactéries doivent être vivantes. Ainsi, certaines espèces de bactéries vivantes et soigneusement choisies ont un effet protecteur sur la réponse allergique contre l’allergène alimentaire, chez ces souris.
Mais par quel mécanisme ces bactéries rétablissent-elles la tolérance orale à l’égard d’un allergène inoffensif ?
La bactériothérapie permet de déjouer un détournement cellulaire
Pour y répondre, les autrices et auteurs de l’étude se sont intéressés aux lymphocytes régulateurs, les casques bleus impliqués dans la tolérance orale.
En les étudiant de plus près, les scientifiques ont remarqué une population de lymphocytes régulateurs bizarres. Ils possèdent bien les marqueurs d’identification des lymphocytes régulateurs mais anormalement accompagnés de marqueurs des cellules de l’immunité de type 2, la force armée pro-inflammatoire responsable des allergies ! Des cellules hybrides ?! De manière intéressante, elles sont présentes chez les souris qui font un choc anaphylactique à l’ovalbumine mais pas chez celles qui sont protégées par la bactériothérapie (Figure 3).
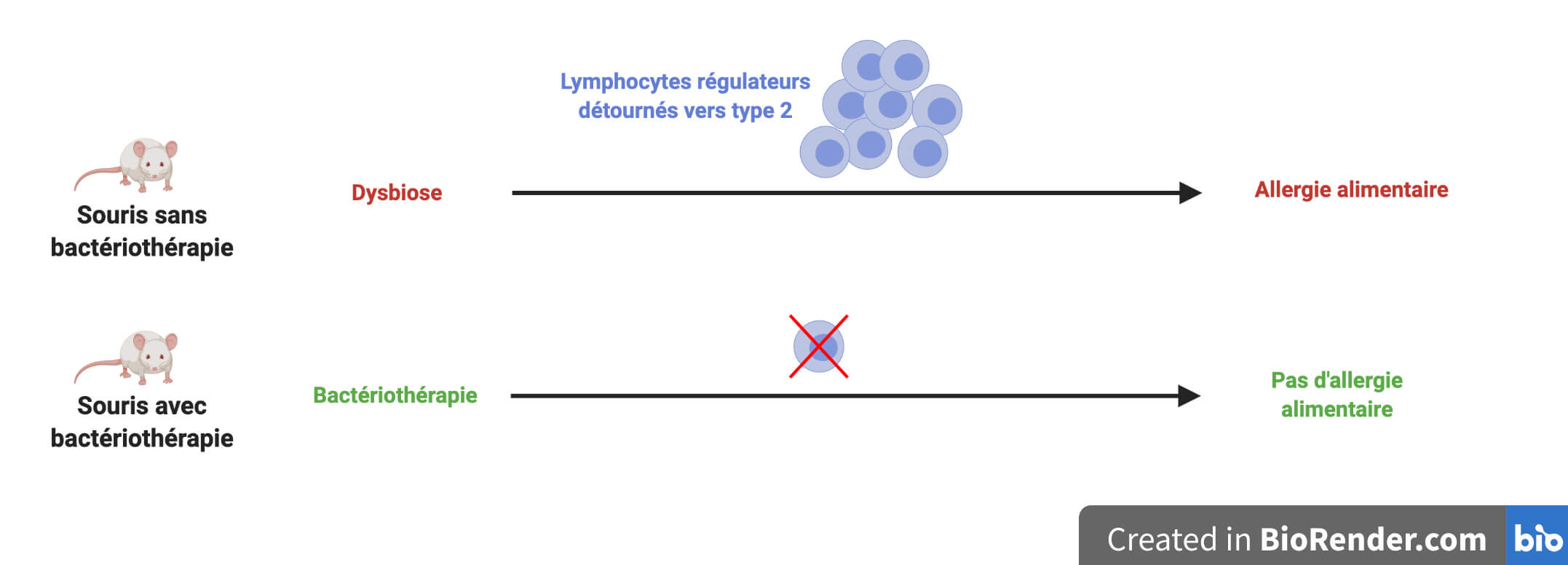
Il se trouve que ce n’est pas la première fois que ces cellules hybrides sont observées. Ce sont d’anciens lymphocytes régulateurs « reprogrammés » en cellules de l’immunité de type 2. De précédentes études ont même montré que cette reprogrammation favorise l’allergie alimentaire [4]. Bingo ! Cela veut dire que les « bonnes » bactéries des cocktails permettent d’empêcher, d’une façon ou d’une autre, la présence de ces cellules qui se sont détournées vers le côté obscur pro-inflammatoire de la réponse immunitaire (Figure 4).

Une unité d’élite au cœur de la tolérance
En allant plus loin dans leurs analyses, les chercheuses et chercheurs de l’équipe découvrent que l’explication se cache au sein d’une unité cellulaire d’élite appartenant aux casques bleus régulateurs. Cette unité régulatrice d’élite n’est présente que chez les souris qui ont reçu la bactériothérapie, et elle est reconnaissable par la présence d’un marqueur appelé RORγt (Figure 5).
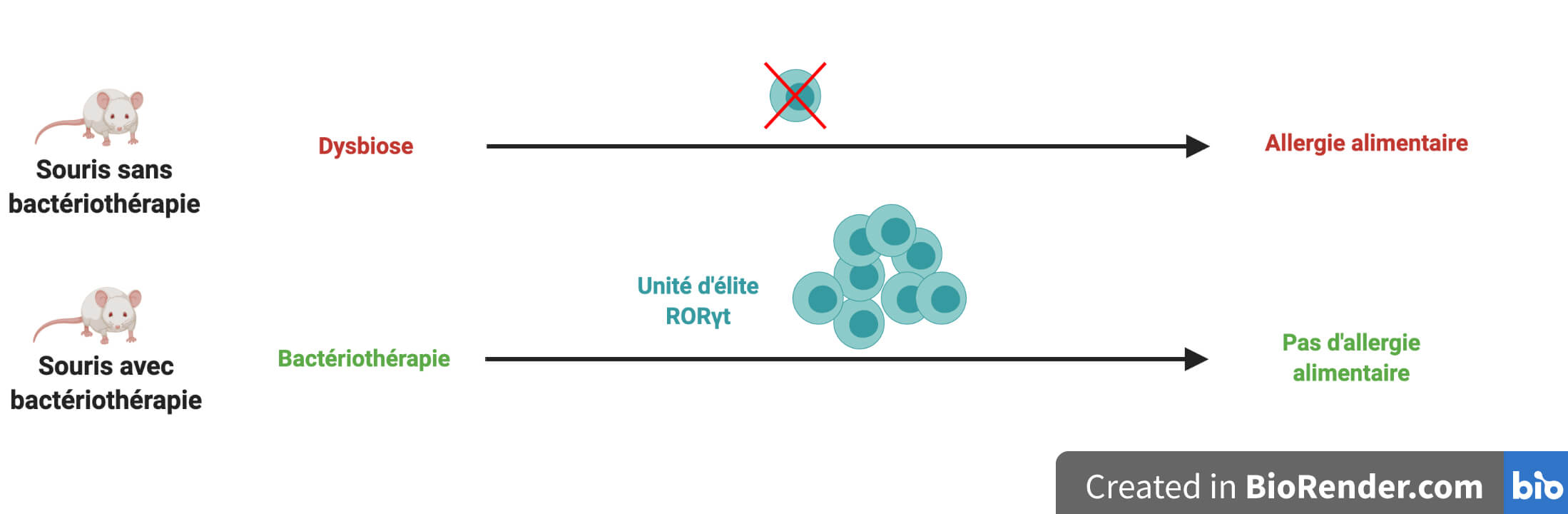
La seule présence d’une population cellulaire chez un groupe de souris et pas chez l’autre peut n’être qu’une coïncidence fortuite. Les scientifiques ont donc cherché un éventuel lien de cause à effet — on parle de lien de causalité — entre cette unité régulatrice d’élite RORγt, la protection conférée par les cocktails de bactéries et les cellules hybrides reprogrammées vers l’immunité de type 2.
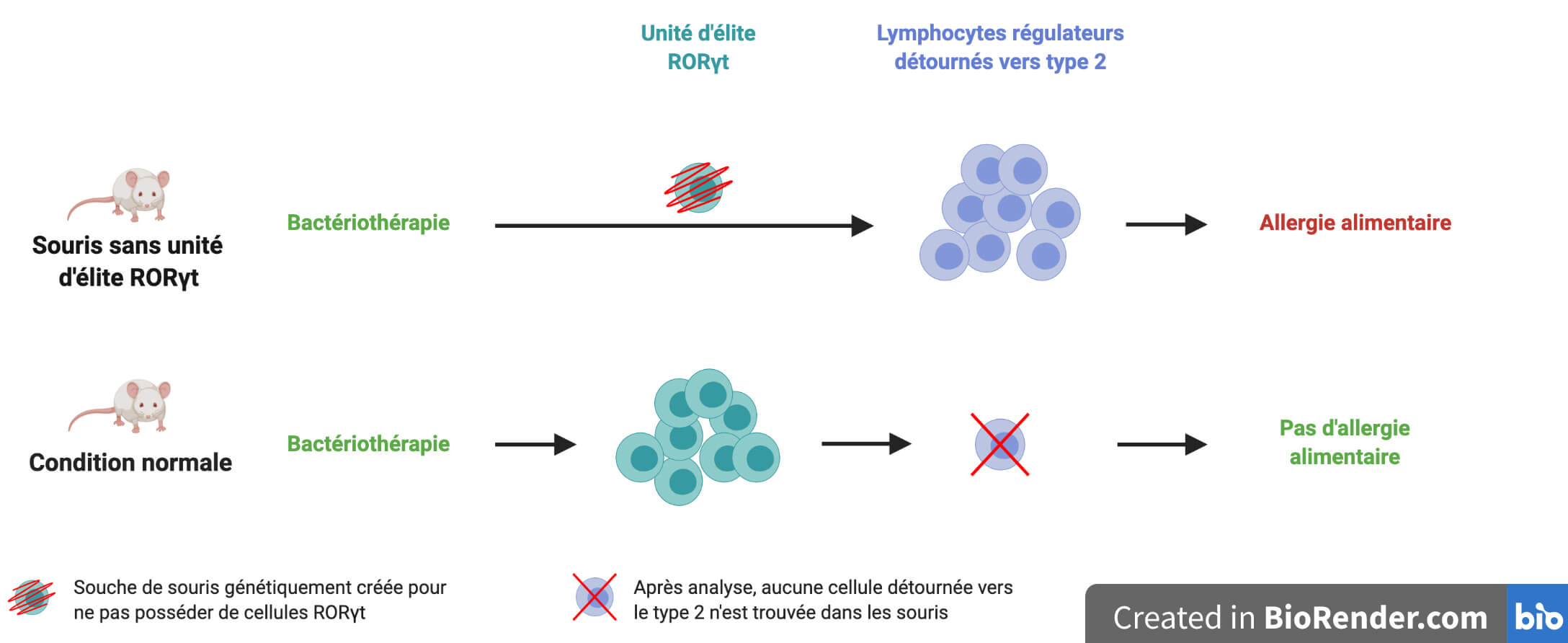
Pour cela, l’équipe a analysé en détail ce qu’il se passe lorsque cette unité d’élite est préalablement supprimée chez les souris soumises au protocole de sensibilisation/déclenchement. En son absence, la bactériothérapie ne protège plus les souris de l’allergie alimentaire, et les souris possèdent alors des lymphocytes régulateurs détournés vers l’immunité de type 2 (Figure 6). La seule différence entre les deux conditions étant l’absence de l’unité régulatrice d’élite, on en conclut que c’est précisément cette population cellulaire qui empêche le détournement vers l’immunité de type 2. Ce résultat confirme donc le rôle clé de cette population cellulaire RORγt dans la protection contre la réaction allergique.
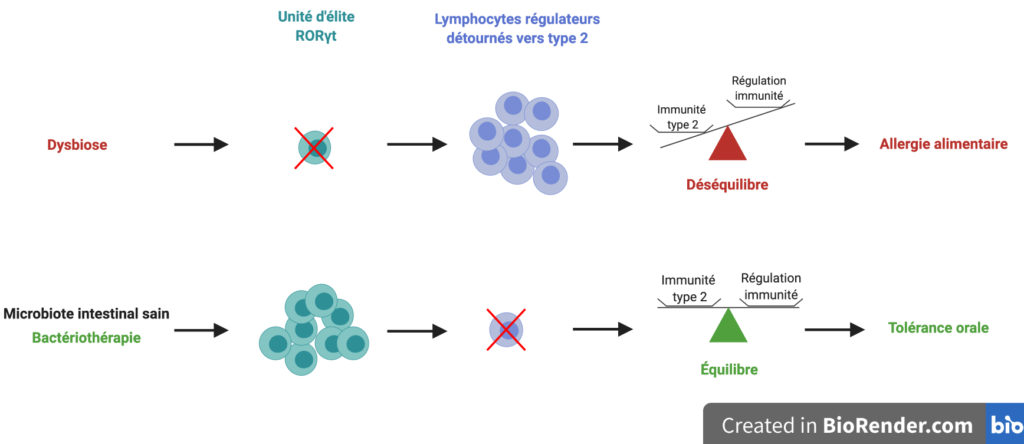
Au terme de cette histoire, l’équipe de recherche a donc montré que des cocktails de « bonnes » bactéries bien choisies permettent de protéger des souris d’une allergie alimentaire. Les bactéries induisent la formation de l’unité régulatrice d’élite RORγt qui empêche à son tour certains lymphocytes régulateurs de basculer vers le côté obscur de la réponse pro-inflammatoire. Cela rétablit la tolérance orale et l’équilibre dans la Force (Figure 7).
Des résultats révolutionnaires ?
Cette publication s’inscrit dans un contexte florissant de travaux étudiant le rôle des bactéries du microbiote intestinal sur notre santé et sur leur potentiel thérapeutique dans de nombreuses pathologies. L’intérêt de cette étude est de proposer une histoire cohérente expliquant les effets de certaines espèces de bactéries du microbiote intestinal sur la tolérance orale, en mettant en lumière le rôle des lymphocytes régulateurs.
Cet impressionnant travail propose une réponse basée sur un modèle précis d’allergie alimentaire chez la souris. Un modèle animal, tout solide qu’il soit, ne reste qu’une façon simplifiée d’approcher la réalité. Les systèmes immunitaires de la souris et de l’humain ne sont pas les mêmes, la composition de leur microbiote non plus. De nombreux travaux sont encore à mener avant de décomposer précisément les étapes depuis la colonisation des bactéries protectrices dans la muqueuse intestinale jusqu’à l’induction de la tolérance orale. Pour autant, si les effets des bactériothérapies continuent d’être confirmés, cela pourrait déboucher sur des applications concrètes même si l’ensemble des mécanismes en jeu n’est pas entièrement compris.
Qu’à cela ne tienne ! D’ici là, la prochaine fois que vous irez faire vos courses, je vous conseille d’ignorer ces crevettes qui vous font saliver et de choisir plutôt des filets de rougets qui ne déclencheront pas la prochaine guerre des clones dans votre estomac !
[*] L’adrénaline est le seul traitement d’urgence de la forme la plus sévère de l’allergie : le choc anaphylactique. Concrètement, le choc anaphylactique est caractérisé par une dilatation des vaisseaux sanguins, ce qui a pour conséquence une baisse dangereuse de la pression artérielle. L’adrénaline entraîne à l’inverse une vasoconstriction très rapide. Les personnes qui savent être sujettes aux réactions allergiques graves (œdème, urticaire géant, choc anaphylactique) possèdent de l’adrénaline dans une sorte de stylo qui permet une auto-injection dans la cuisse.
[**] Il est important de noter que je précise toujours « chez ces souris » ou « dans ce modèle de souris ». En effet, le résultat d’une expérience dépend toujours des conditions dans lesquelles cette expérience a été réalisée. Cela est d’autant plus important pour toutes les expériences qui se font sur du matériel vivant, en biologie et recherche biomédicale. Il se pourrait donc que dans un autre modèle de souris, l’effet observé soit différent.
[***] Grogu est un personnage fictif central de la série The Mandalorian, dans l’univers de Star Wars. Ancien apprenti Jedi, il maîtrise la Force.
[1] Azad M.B., et al., Infant gut microbiota and food sensitization: associations in the first year of life. Clinical and experimental allergy, 2015. DOI : 10.1111/cea.12487. [Publication scientifique]
[2] Noval Rivas M., et al., A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis. The Journal of Allergy and Clinical Immunology, 2013. DOI : 10.1016/j.jaci.2012.10.026. [Publication scientifique]
[3] Kverka M., et al., Oral administration of Parabacteroides distasonis antigens attenuates experimental murine colitis through modulation of immunity and microbiota composition. Clinical & Experimental Immunology, 2010. DOI : 10.1111/j.1365-2249.2010.04286.x. [Publication scientifique]
[4] Noval Rivas M., et al., Regulatory T Cell Reprogramming toward a Th2-Cell-like Lineage Impairs Oral Tolerance and Promotes Food Allergy. Immunity, 2015. DOI : 10.1016/j.immuni.2015.02.004. [Publication scientifique]
Écriture : Eléonore Pérès
Relecture scientifique : Maud Pascal et Aurélien Schwob
Relecture de forme : Agathe Pralus et Jérémy Ferrand
Temps de lecture : environ 18 minutes.
Thématiques : Immunologie (Biologie)
Publication originale : Abdel-Gadir A., et al., Microbiota therapy acts via a regulatory T cell MyD88/RORγt pathway to suppress food allergy. Nature Medecine, 2019. DOI : 10.1038/s41591-019-0461-z
Version libre disponible ici.

Saviez-vous que notre organisme contient au moins autant de bactéries que de cellules humaines ? Alors que l’on commence à peine à entrevoir l’étendue de l’influence du microbiote sur notre santé, son potentiel thérapeutique semble déjà immense. Dans un contexte foisonnant d’explorations de ces propriétés à visée médicale, la publication d’Azza Abdel-Gadir et ses collègues parue en 2019 présente un cocktail de bactéries permettant de protéger des souris d’une allergie alimentaire grave. Comment ? En empêchant une population cellulaire qui prône la tolérance immunitaire de se détourner vers le côté obscur de la Force.
La régulation du système immunitaire est un jeu d’équilibriste : un faux pas et tout se dérègle. Ici, nous ne sommes pas au cinéma, il n’y a ni gentils ni méchants. Mais deux entités cellulaires dont les effets s’opposent pourtant. D’un côté, les bataillons armés pro-inflammatoires qui détectent et neutralisent les ennemis : des microorganismes pathogènes ou d’éventuelles cellules cancéreuses. De l’autre, les casques bleus anti-inflammatoires, évitant que les forces armées ne s’en prennent de manière injustifiée aux cellules du soi, à la flore microbienne ou à des éléments extérieurs inoffensifs comme le pollen ou les aliments. L’équilibre entre ces deux forces est une clé du maintien de l’intégrité de notre organisme, et donc de notre santé.
Parmi les bataillons armés pro-inflammatoires, chacun sa spécialité. Par exemple, les différentes cellules immunitaires de type 1 coordonnent la réponse contre les virus et les bactéries intracellulaires, ce qui conduit à l’élimination des cellules infectées. La réponse immunitaire de type 2, qui va nous intéresser ici, lutte principalement contre les pathogènes extracellulaires grâce à des anticorps spécifiquement orientés contre certaines parties de ces organismes appelées antigènes.
Les principaux membres des casques bleus anti-inflammatoires sont les lymphocytes T régulateurs (Treg). Ils sont caractérisés par l’expression du marqueur FoxP3 et sont classés en deux populations distinctes selon le moment où ils l’expriment. Les Treg dits naturels expriment FoxP3 dès la fin de leur développement dans le thymus. Ils participent à la régulation de la réponse immunitaire après une infection. À l’inverse, les Treg induits (iTreg) ne se mettent à exprimer FoxP3 qu’après avoir élu résidence dans un tissu en périphérie. Ils sont impliqués dans la tolérance du système immunitaire vis-à-vis des antigènes inoffensifs présents dans le tissu en particulier.
La muqueuse intestinale est un terrain d’étude de ces deux forces particulièrement intéressant : la surface en contact avec l’extérieur est très étendue et le risque de déséquilibre permanent. C’est en effet la porte d’entrée d’organismes pathogènes (virus, champignons, vers, etc.), mais aussi d’antigènes alimentaires bénins rencontrés à chaque repas. Et c’est l’habitat des 38 mille milliards de bactéries (environ ![]() ) et des autres microorganismes pacifiques et bénéfiques qui composent notre microbiote intestinal. Le mécanisme actif par lequel le microbiote intestinal et les allergènes alimentaires sont protégés des attaques du système immunitaire est appelé tolérance orale.
) et des autres microorganismes pacifiques et bénéfiques qui composent notre microbiote intestinal. Le mécanisme actif par lequel le microbiote intestinal et les allergènes alimentaires sont protégés des attaques du système immunitaire est appelé tolérance orale.
Si votre gorge se met à gonfler alors que vous mangez de la pâte de noisette, c’est que l’équilibre qui permet la tolérance orale s’est rompu. Un bataillon armé de la réponse immunitaire de type 2 s’en est pris, sans raison, à un allergène de noisette. Plus précisément, il y a eu production et libération très rapide d’un type d’anticorps, une immunoglobuline E (IgE) spécifique de l’allergène, sous l’action d’un médiateur de la communication intercellulaire : l’interleukine 4 (IL4). Face à cette réponse exacerbée et injustifiée, les casques bleus T régulateurs n’ont pas réussi à calmer le jeu [1]…
Les allergies alimentaires peuvent être de gravités variables : de la simple gêne au choc anaphylactique gravissime. Des traitements existent pour les personnes les plus atteintes, mais ils sont fastidieux, très longs et ne fonctionnent pas toujours.
Greffer de « bonnes » bactéries du microbiote pour soigner l’allergie alimentaire ?
Une nouvelle piste thérapeutique envisage de profiter des vertus potentielles du microbiote intestinal bactérien. Il est majoritairement composé de cinq embranchements phylogénétiques (les phyla) comprenant chacun plusieurs espèces. Or, des études indiquent depuis plusieurs années qu’un déséquilibre dans la diversité et/ou l’abondance relative de ces espèces — appelé dysbiose — serait associé, entre autres, à l’allergie alimentaire [2, 3]. Se pourrait-il alors que le rétablissement d’un microbiote intestinal équilibré ait un potentiel thérapeutique pour rétablir la tolérance orale ? Pour tenter d’y répondre, nous allons suivre Azza Abdel-Gadir et ses collègues dans la caractérisation des effets d’une bactériothérapie sur l’allergie alimentaire.
L’équipe a commencé par étudier la composition du microbiote intestinal bactérien de très jeunes enfants nord-américains atteints d’allergies alimentaires. Elle a montré que ces allergies sont associées à une modification de l’abondance relative de certaines espèces de bactéries : certaines sont plus ou moins représentées que dans le microbiote d’enfants non allergiques. Est-ce que cette dysbiose pourrait expliquer à elle seule l’allergie alimentaire des enfants ? Pour des raisons aussi bien éthiques que pratiques, les chercheuses et chercheurs ont choisi de tester cette hypothèse dans un modèle d’allergie alimentaire chez la souris.
Quand des souris deviennent allergiques aux œufs…
Pour cela, les expériences ont été menées sur une souche de souris génétiquement sensible aux allergies. Elle possède en effet une mutation dans le gène du récepteur de l’IL4 qui le rend constamment actif, ce qui exacerbe la réponse immunitaire de type 2 et la production d’IgE. Les souris possèdent un « terrain » allergique. Nous les appellerons souris IL4ra. À l’aide d’un protocole simple, les scientifiques peuvent rendre ces souris allergiques à un allergène précis.
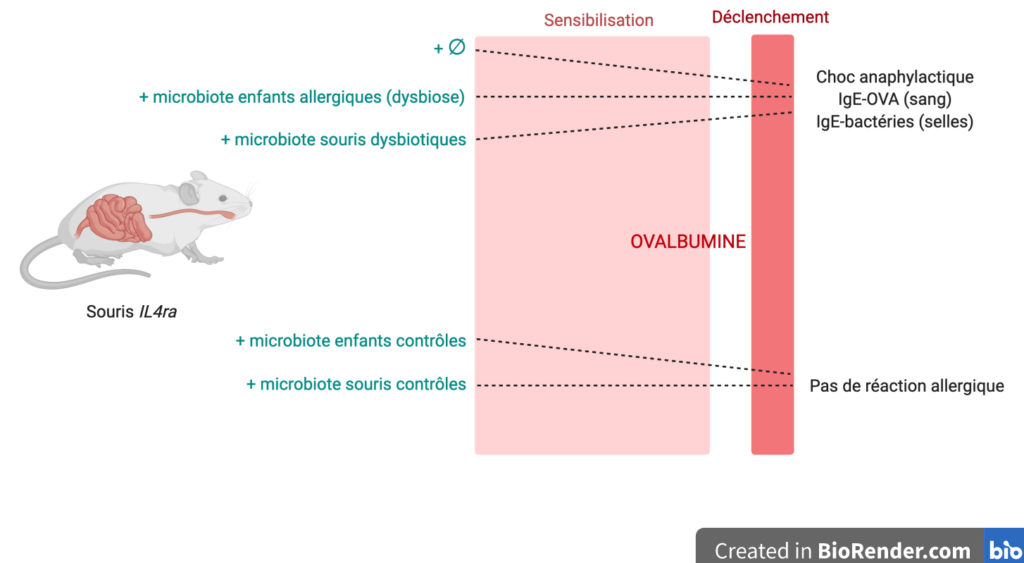
Le processus de l’allergie dépendante des IgE se décompose en deux étapes (Figure 1, haut) :
- Une phase de sensibilisation pendant laquelle l’administration répétée d’un allergène, chez une souris dite sensible, induit une réaction immunitaire et la production importante d’IgE spécifiques. Ces IgE se fixent à la surface de mastocytes et de basophiles remplis de molécules médiatrices de la réaction allergique (comme l’histamine).
- Une phase de déclenchement lors de laquelle l’allergène introduit est reconnu par les IgE. Cela induit la dégranulation des mastocytes et des basophiles, libérant les molécules médiatrices qui induisent toutes les manifestations de la réponse allergique.
Le protocole utilisé chez les souris IL4ra est basé sur ce modèle. Dans un premier temps, la souris est sensibilisée par voie orale avec de l’ovalbumine, un allergène dérivé de l’œuf couramment utilisé en laboratoire (Figure 1, bas). Lors du déclenchement de la réaction allergique, la souris fait un choc anaphylactique caractérisé par une forte et rapide diminution de sa température corporelle d’environ 2°C et la présence dans le sang d’IgE spécifiques de l’ovalbumine.
Les membres de l’équipe de recherche ont alors étudié l’effet du microbiote des enfants susceptibles aux allergies alimentaires sur la réaction allergique de ces souris. Pour cela, ils leur ont transféré, par voie orale, les bactéries du microbiote récupérées dans les selles des enfants. Ils ont choisi d’utiliser des souris totalement dépourvues de microbiote afin que l’effet observé soit uniquement dû aux bactéries intestinales transplantées qui proviennent soit des enfants allergiques soit des enfants non allergiques (groupe contrôle). Après déclenchement de la réaction allergique, les souris dont l’intestin est colonisé par les bactéries de la flore des enfants du groupe contrôle ne font pas de choc anaphylactique. Le microbiote « sain » les a protégées de la réaction allergique. Ce qui n’est pas le cas des souris greffées avec les bactéries du microbiote des enfants allergiques : elles répondent de la même façon que des souris non transplantées ! (Figure 2).
Pour appuyer ce résultat de manière plus physiologique, les auteurs et autrices de l’étude ont reproduit l’expérience avec du microbiote de souris : soit de souris ayant à la fois un terrain allergique associé à un microbiote naturellement dysbiotique soit de souris saines. Le même effet est observé, montrant que le déséquilibre de la flore microbienne associé à une allergie alimentaire suffit à permettre l’induction de l’allergie alimentaire à l’ovalbumine dans ce modèle de souris (Figure 2).
… et à leur propre microbiote !
Les IgE anti-ovalbumine détectées dans le sang de ces souris attestent d’une réaction immunitaire dirigée spécifiquement contre l’ovalbumine. Mais de manière inattendue, l’équipe a également trouvé des IgE fixées à des bactéries dans les selles des enfants (4 %) et des souris (8 %) allergiques, alors que ce pourcentage est quasi nul chez les individus contrôles. Cela indique une réaction allergique dirigée non seulement contre les allergènes alimentaires, mais aussi directement contre certaines bactéries du microbiote intestinal (Figure 2) !
Les chercheuses et chercheurs n’ont pas caractérisé les espèces de bactéries qui sont concernées par cette fixation d’IgE. Il aurait pourtant été très intéressant, pour la suite de l’étude, de savoir si cela correspond aux bactéries sous-représentées dans le microbiote dysbiotique ou si toutes les espèces sont concernées.
À ce stade, les autrices et auteurs de la publication ont montré que dans un terrain allergique, la transplantation d’un microbiote d’individus non allergiques permet d’inhiber le déclenchement d’une réaction allergique. Mais cet effet n’est-il observable qu’en transplantant un microbiote complet ? Ou serait-il possible que le potentiel protecteur dépende de certaines espèces particulières ?
Un smoothie de bactéries et c’est reparti !
L’équipe de recherche a constitué deux cocktails différents de bactéries du microbiote humain. Le premier est une association de six espèces de bactéries du phylum des Firmicutes, et plus précisément de la classe des Clostridia, anormalement sous-représentées dans le microbiote intestinal des enfants allergiques. Le second est composé de cinq bactéries du phylum des Bacteroidetes, déjà connues pour protéger de pathologies inflammatoires [4].
Azza Abdel-Gadir et ses collègues ont alors administré l’une ou l’autre de ces bactériothérapies par voie orale aux souris IL4ra puis les ont soumises au protocole de sensibilisation/déclenchement de la réaction allergique (Figure 1). L’effet de la bactériothérapie a d’abord été testé lorsque le protocole est réalisé sans ovalbumine : c’est le groupe contrôle. À la place, les souris reçoivent des doses comparables de solution physiologique. Comme attendu, elles ne présentent pas de symptôme de réaction allergique : température corporelle stable et absence d’IgE dirigées contre l’ovalbumine (Figure 3, en bleu). L’autre groupe de souris est sensibilisé à l’ovalbumine. Celles qui reçoivent l’un des deux cocktails de bactériothérapie ne présentent pas non plus de réaction allergique à l’ovalbumine : la température du corps et le taux d’IgE contre l’ovalbumine correspondent à ce qui est observé chez les souris du groupe contrôle. Ainsi, ces bactériothérapies protègent les souris de l’allergie à l’ovalbumine (Figure 3). Ces deux cocktails « protecteurs » restaurent également la proportion d’IgE fixées aux bactéries retrouvées dans les selles. Elle passe de 8 % chez les souris non transplantées, qui font donc une réaction allergique, à moins de 1 % avec les cocktails de Clostridia ou de Bacteroidetes.
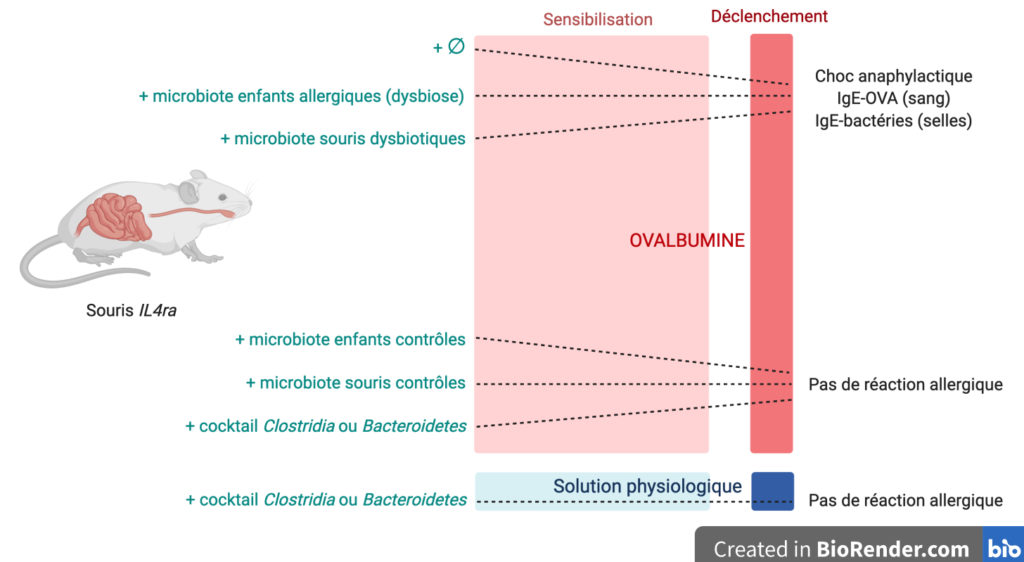
L’effet protecteur des deux bactériothérapies sur l’allergie alimentaire est-elle pour autant due aux bactéries vivantes ou à des composés qu’elles pourraient secréter ? Lorsque les bactéries sont tuées par choc thermique avant la transplantation, il n’y a plus d’effet protecteur contre l’allergie alimentaire. De plus, alors que certains composés microbiens sont connus pour promouvoir la tolérance orale [5], l’administration de ces composés, par voie orale durant la phase de sensibilisation, n’a pas non plus d’effet protecteur.
Ainsi, des espèces de bactéries vivantes et soigneusement choisies ont un effet protecteur sur la réponse allergique contre l’allergène alimentaire et contre le microbiote. Les auteurs et autrices ont même remarqué des effets protecteurs avec la greffe d’une seule espèce de Clostridia, suggérant que certaines espèces seraient très protectrices. Mais par quel mécanisme agissent-elles ?
La bactériothérapie permet de déjouer un détournement cellulaire
L’équipe chargée de l’étude s’est intéressée à la population cellulaire impliquée dans la tolérance orale : les lymphocytes iTreg. Plus précisément, elle les a étudiés directement dans leur centre de contrôle situé au niveau des ganglions lymphatiques de l’intestin des souris.
Les scientifiques ont comparé la proportion de ces cellules dans les ganglions des souris IL4ra rendues allergiques à l’ovalbumine, avec et sans bactériothérapie. Pour cela, l’équipe a utilisé la technique de la cytométrie en flux dans laquelle les populations cellulaires sont identifiées selon les antigènes qui leur sont propres. Les cellules sont baignées dans un mélange contenant des anticorps spécifiques de ces antigènes, couplés à des molécules fluorescentes. En étudiant la fluorescence de chaque anticorps, on peut ainsi remonter à la proportion des cellules d’intérêt. Ici, l’équipe a commencé par sélectionner tous les lymphocytes qui expriment FoxP3. Puis parmi ceux-ci, elle a comparé dans chaque groupe de souris la proportion de cellules qui expriment en plus les marqueurs spécifiques des Treg induits. Sans grande surprise, les autrices et auteurs observent davantage de cellules iTreg chez les souris qui ont reçu une bactériothérapie protectrice. La proportion passe de 10 % des lymphocytes exprimant FoxP3 chez les souris sans bactériothérapie à 40-50 % des lymphocytes exprimant FoxP3 avec les deux cocktails protecteurs ! Cela indique que la protection contre l’allergie alimentaire conférée par les bactéries est associée à davantage de cellules iTreg.
Azza Abdel-Gadir et ses collègues ont souhaité aller plus loin dans la caractérisation des cellules T régulatrices de ces souris. Il se trouve en effet que l’équipe a précédemment montré, dans ce même modèle de souris et chez des patients humains souffrants d’allergies alimentaires, que certaines cellules Treg aux fonctions normalement suppressives sont « reprogrammées » en cellules de la réponse immunitaire de type 2 dont ils se mettent à exprimer des marqueurs, parmi lesquels l’IL4. Cette reprogrammation serait alors responsable de la perte de la tolérance orale et d’une hypersensibilité allergique [6, 7]. Les bactéries protectrices pourraient-elles empêcher ce détournement vers le côté obscur pro-inflammatoire de la réponse immunitaire ? Pour en avoir le cœur net, l’équipe a donc recherché par cytométrie en flux d’éventuels lymphocytes aux marqueurs à la fois de Treg — comme FoxP3 — mais aussi de l’immunité de type 2 — comme l’IL4. Et bingo ! Chez les souris IL4ra non transplantées puis rendues allergiques à l’ovalbumine, la proportion de ces cellules hybrides est beaucoup plus importante (environ 10-15 % des lymphocytes exprimant FoxP3) que chez les souris qui ont reçu la bactériothérapie protectrice (environ 2-5 % des lymphocytes exprimant FoxP3).
Il y a donc d’un côté davantage de Treg détournés dans les souris non protégées de l’allergie alimentaire (non transplantées) et de l’autre davantage de iTreg dans les souris protégées grâce à la bactériothérapie. Maintenant, serait-il possible que ces iTreg participent directement à l’échec du détournement de certains Treg vers un profil de type 2 (Figure 4) ? Pour creuser cette piste, l’équipe a étudié plus en détail la population des iTreg qui augmente chez les souris protégées de l’allergie alimentaire par les bactéries protectrices. Elle s’est aperçue qu’une grande partie de ces iTreg exprime une protéine portant le doux nom de RORγt. Or, la génération de cellules Treg RORγt+ est connue pour être induite par le microbiote intestinal et pour permettre de réguler la réponse de type 2 chez la souris [8] ! C’est d’autant plus intéressant que les auteurs et autrices de l’étude découvrent alors que la proportion des cellules Treg RORγt+ est également diminuée dans le sang d’individus humains d’âges variés souffrant d’allergies alimentaires ! À ce stade-là, ce n’est sûrement pas une coïncidence… sauf que pour l’instant ce ne sont que des suppositions basées sur des corrélations (Figure 4).
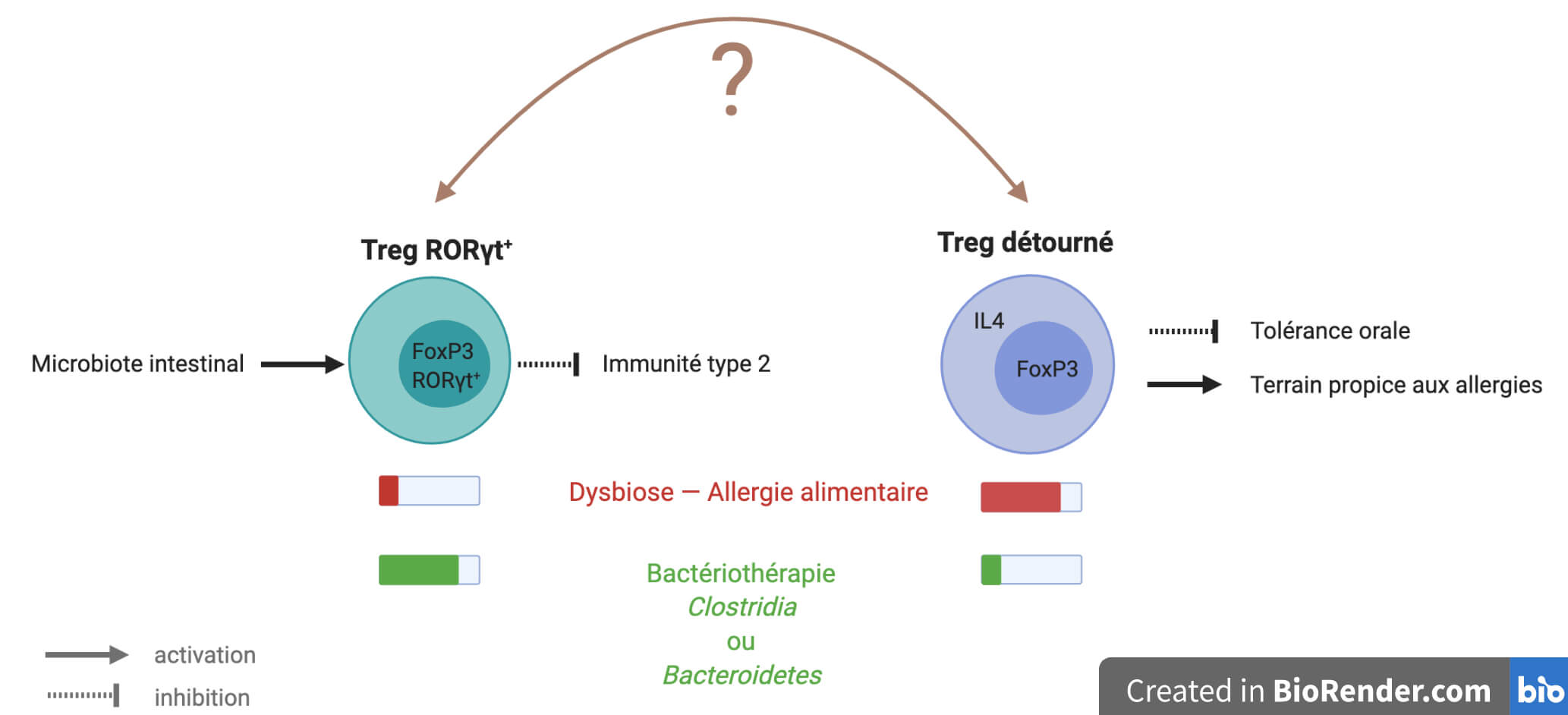
Les cellules iTreg RORγt+ au cœur de la tolérance
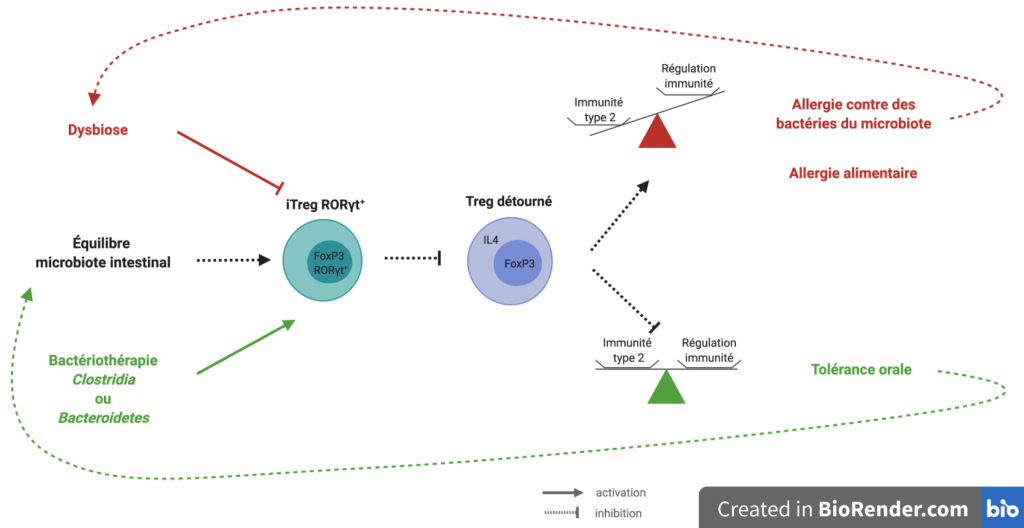
Pour étudier un éventuel lien de causalité entre la présence de cellules iTreg RORγt+et la diminution des Treg détournées vers l’immunité de type 2, les chercheurs et chercheuses ont testé leur protocole d’allergie alimentaire en changeant de souche de souris. En plus d’être IL4ra, donc de terrain propice aux allergies, la souche possède une mutation invalidante dans le gène codant pour la protéine RORγt+ ; cette mutation étant conditionnée par l’expression du gène FOXP3. Aussi, la protéine RORγt+ est absente uniquement dans les lymphocytes T régulateurs.
Nous l’avons vu, dans les souris IL4ra classiques, le déclenchement de la réaction allergique à l’ovalbumine provoque un choc anaphylactique. La transplantation avec l’un ou l’autre des cocktails de bactéries protège de la réaction allergique et diminue le nombre de cellules Treg détournées vers l’immunité de type 2. Dans cette nouvelle souche de souris sans population de cellules iTreg RORγt+, la bactériothérapie avec les Clostridia et les Bacteroidetes n’a plus d’effet protecteur : les souris font un choc anaphylactique accompagné d’un détournement des Treg vers la réponse de type 2. Étant donné que la différence entre ces deux conditions est uniquement la présence des iTreg RORγt+, on en conclut que cette population cellulaire, induite par la bactériothérapie, est responsable au moins en partie de la tolérance du système immunitaire face à l’allergène ovalbumine et aux bactéries du microbiote. Cette tolérance implique l’arrêt du détournement de certaines cellules Treg vers un phénotype pro-inflammatoire de type 2.
L’ensemble des résultats de cet impressionnant travail met en lumière le rôle de certaines espèces de bactéries du microbiote intestinal dans le délicat équilibre actif qui permet la tolérance orale. Vivantes, elles ont la capacité d’induire l’expression de RORγt chez les iTreg, ce qui rétablit l’équilibre dans la Force en limitant la reprogrammation de cellules casques bleus vers un devenir pro-inflammatoire belliqueux (Figure 5).
Des résultats révolutionnaires ?
Cette publication s’inscrit dans un contexte florissant de travaux étudiant le rôle des bactéries du microbiote intestinal sur notre santé et sur leur potentiel thérapeutique dans de nombreuses pathologies. L’intérêt de cette étude, parue en 2019 dans Nature Medecine, est de proposer une histoire cohérente expliquant les effets de certaines espèces de bactéries du microbiote intestinal sur la tolérance orale, en mettant en lumière les cellules T régulatrices. La publication confirme et relie ainsi entre eux des travaux de recherche antérieurs.
Sa force est également d’avoir croisé des expériences chez la souris avec des échantillons humains. Cela renforce les conclusions obtenues dans leur modèle souris et suggère que ça pourrait être transposable à l’humain. Pour autant, un modèle animal, tout solide qu’il soit, ne reste qu’une façon simplifiée d’approcher la réalité. Les systèmes immunitaires de la souris et de l’humain ne sont pas les mêmes, la composition de leur microbiote non plus. De nombreux travaux sont encore à imaginer et à mener avant de décomposer précisément les étapes depuis la colonisation des bactéries protectrices dans la muqueuse intestinale jusqu’à l’induction de la tolérance orale. Pour autant, si les effets des bactériothérapies continuent d’être confirmées, cela pourrait déboucher sur des applications concrètes même si l’ensemble des mécanismes en jeu n’est pas entièrement compris.
Pour finir, gardons à l’esprit que nous formons avec notre microbiote intestinal un écosystème très complexe que l’on découvre à peine. On peut supposer que les mécanismes et les étapes liant dysbiose, rupture de la tolérance orale et pathologies allergiques impliquent d’autres protagonistes. Par exemple, une dérégulation de l’équilibre délicat — encore un ! — entre des bactéries protectrices et des virus bactériophages pourrait être un nouveau chaînon à prendre en compte dans les prochains travaux [9].
[1] Satitsuksanoa P., et al., Regulatory Immune Mechanisms in Tolerance to Food Allergy. Frontiers in Immunology, 2018. DOI : 10.3389/fimmu.2018.02939. [Review]
[2] Azad M.B., et al., Infant gut microbiota and food sensitization: associations in the first year of life. Clinical and experimental allergy, 2015. DOI : 10.1111/cea.12487. [Publication scientifique]
[3] Noval Rivas M., et al., A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis. The Journal of Allergy and Clinical Immunology, 2013. DOI : 10.1016/j.jaci.2012.10.026. [Publication scientifique]
[4] Kverka M., et al., Oral administration of Parabacteroides distasonis antigens attenuates experimental murine colitis through modulation of immunity and microbiota composition. Clinical & Experimental Immunology, 2010. DOI : 10.1111/j.1365-2249.2010.04286.x. [Publication scientifique]
[5] Luu M., et al., Exploring the Molecular Mechanisms Underlying the Protective Effects of Microbial SCFAs on Intestinal Tolerance and Food Allergy. Frontiers in Immunology, 2020. DOI : 10.3389/fimmu.2020.01225. [Publication scientifique]
[6] Abdel-Gadir A., et al., Oral immunotherapy with omalizumab reverses the Th2 cell-like programme of regulatory T cells and restores their function. Clinical and experimental allergy, 2018. DOI : 10.1111/cea.13161. [Publication scientifique]
[7] Noval Rivas M., et al., Regulatory T Cell Reprogramming toward a Th2-Cell-like Lineage Impairs Oral Tolerance and Promotes Food Allergy. Immunity, 2015. DOI : 10.1016/j.immuni.2015.02.004. [Publication scientifique]
[8] Ohnmacht C., et al., The microbiota regulates type 2 immunity through RORγt+ T cells. Science, 2015. DOI : 10.1126/science.aac4263. [Publication scientifique]
[9] Lourenço M., et al., The Spatial Heterogeneity of the Gut Limits Predation and Fosters Coexistence of Bacteria and Bacteriophages. Cell Host & Microbe, 2020. DOI : 10.1016/j.chom.2020.06.002. [Publication scientifique]