Ce papier-mâché a été écrit par des étudiantes de Master 1 du Magistère Européen de Génétique de l’Université Paris-Cité, dans le cadre d’une collaboration pédagogique pour l’UE Communication scientifique. La publication scientifique choisie provient de l’équipe d’accueil de stage de Licence 3 d’une des 3 autrices.
Promotion 2022-2023.
Écriture : Anna Cloarec, Aurélie Claquin, Irié Carel
Relecture scientifique : Équipe pédagogique : Sandra Claret, Sandrine Caburet, Pierre Kerner et Patrick Laurenti
Relecture de forme : Mélanie Laborde et Pierre Marrec
Temps de lecture : environ 12 minutes.
Thématiques : Biologie du développement (Biologie)
Publication originale : Ikmi A., et al., Feeding-dependent tentacle development in the sea anemone Nematostella vectensis. Nature communications, 2020. DOI : 10.1038/s41467-020-18133-0
Stella, jeune anémone de mer, se prélasse dans l’eau. Un beau jour, au gré des marées, un splendide festin de minuscules crustacés s’offre à elle. Avec ses quatre bras tentaculaires, elle mange par petites bouchées sans s’arrêter. À la suite de cette copieuse collation, elle se regarde dans la glace et quelle surprise ! Ce ne sont pas des bourrelets qu’elle voit poindre, mais 2, puis 4, puis 12 bourgeons de tentacules. Mais comment cela est-il possible ? N’attendez plus, c’est au menu d’un article scientifique publié par l’équipe d’Aissam Ikmi en 2020.
Menu découverte : Stella, l’anémone de mer Nematostella vectensis
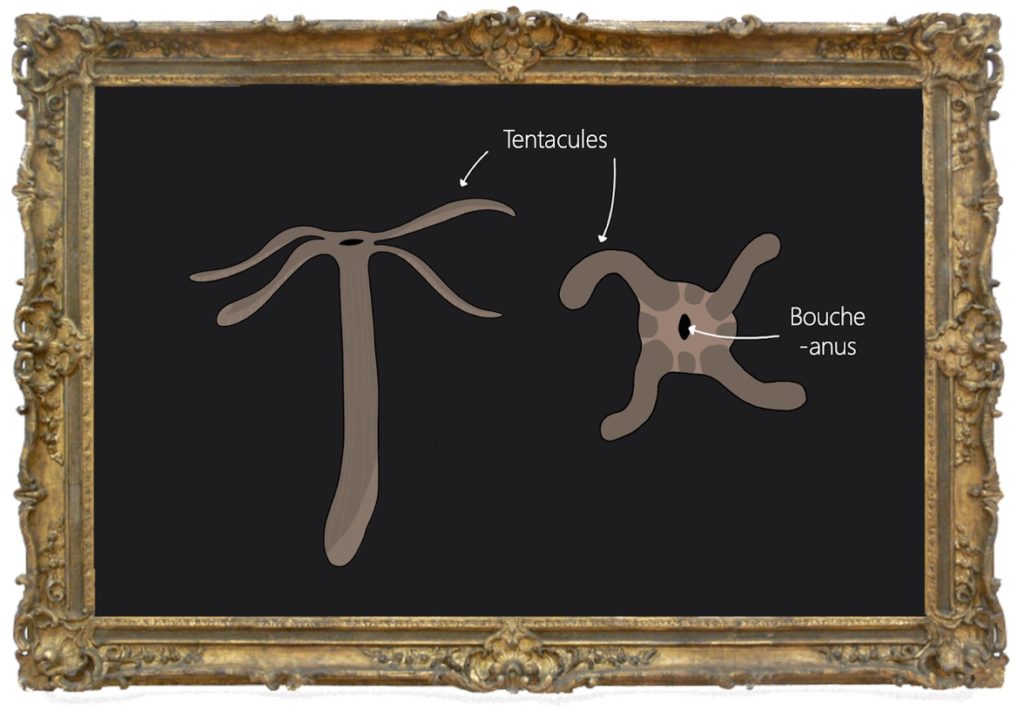
L’anémone Nematostella vectensis, surnommée Stella, est un cnidaire comme ses cousines lointaines les méduses. Le terme cnidaire a été construit à partir du grec knidê, qui signifie « ortie ». En effet, les cnidaires sont urticants car leurs tentacules sont garnis de petits harpons venimeux. Les tentacules, qui permettent à Stella de chasser ou de se défendre, entourent un orifice unique. L’autre extrémité du corps des cnidaires étant close, cet orifice fait office à la fois de bouche et d’anus (Figure 1).
Entrée : tagliatelles de tentacules
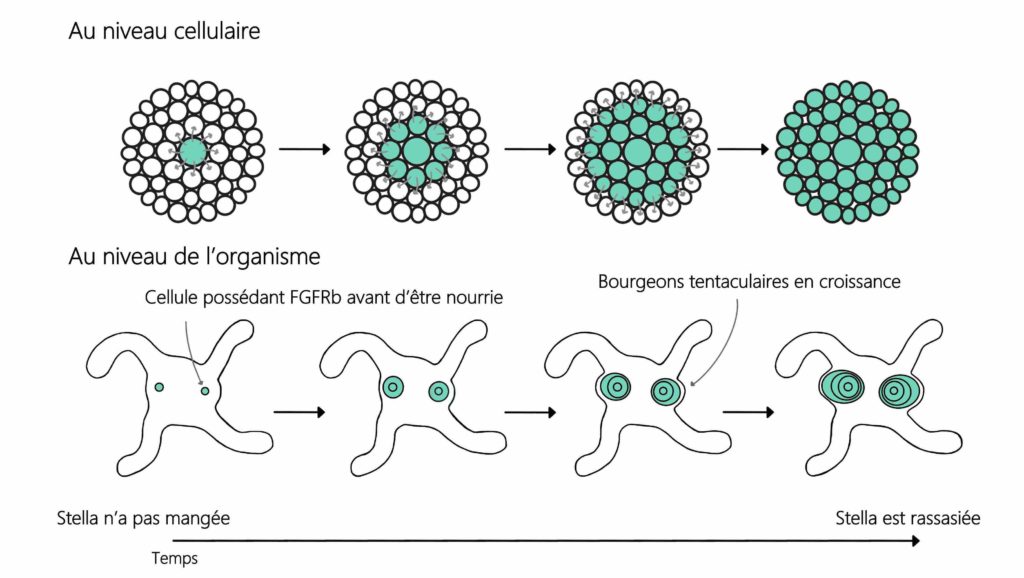
Stella peut survivre très longtemps en absence de nourriture (au moins plusieurs mois). Dans ces conditions, bien qu’elle ne puisse pas effectuer son cycle de vie complet et se reproduire, elle grandit jusqu’à développer ses quatre premiers tentacules. Les réserves nutritives de l’œuf lui fournissent en effet l’énergie nécessaire au développement de ces tentacules. En l’absence de nourriture, elle garde son petit corps plus économe en énergie. Mais dès qu’elle devient autonome pour se nourrir, elle peut manger, grandir et développer de nouveaux tentacules. C’est cette transition cruciale qui intéresse l’équipe d’Aissam Ikmi du Laboratoire Européen de Biologie Moléculaire (EMBL), qui s’est demandé comment la consommation de nourriture intervient dans le développement de ces tentacules supplémentaires.
En étudiant un millier de congénères de Stella, l’équipe a décrit le déroulé du développement des tentacules. En l’absence de nourriture dans le milieu maritime, le développement s’arrête effectivement à quatre tentacules. Cependant, lorsqu’elle a la possibilité de se nourrir (Figure 2), toute la fratrie développe progressivement, de manière ordonnée dans le temps et dans l’espace, seize tentacules voire parfois plus, et ce proportionnellement à la durée de l’apport alimentaire [voir Pour approfondir].
Plat principal : farandole de cellules
La petite anémone étant bien nourrie, logée, blanchie dans l’aquarium du laboratoire, l’équipe d’Aissam Ikmi s’est intéressé à la multiplication des cellules de Stella, mécanisme essentiel pour le développement d’un organisme complexe.
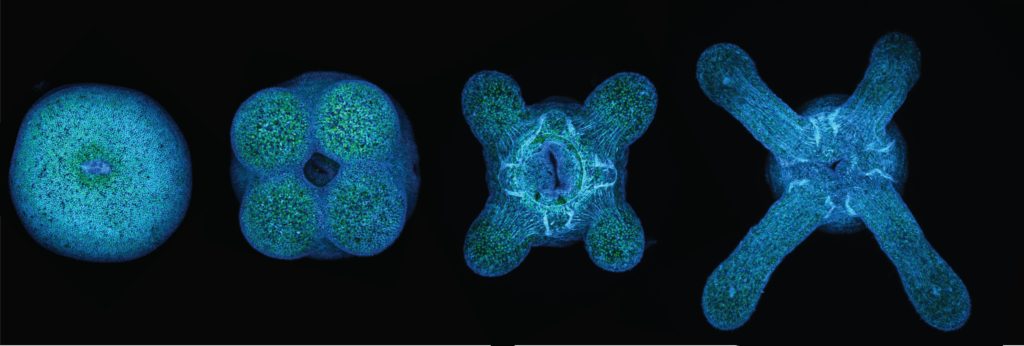
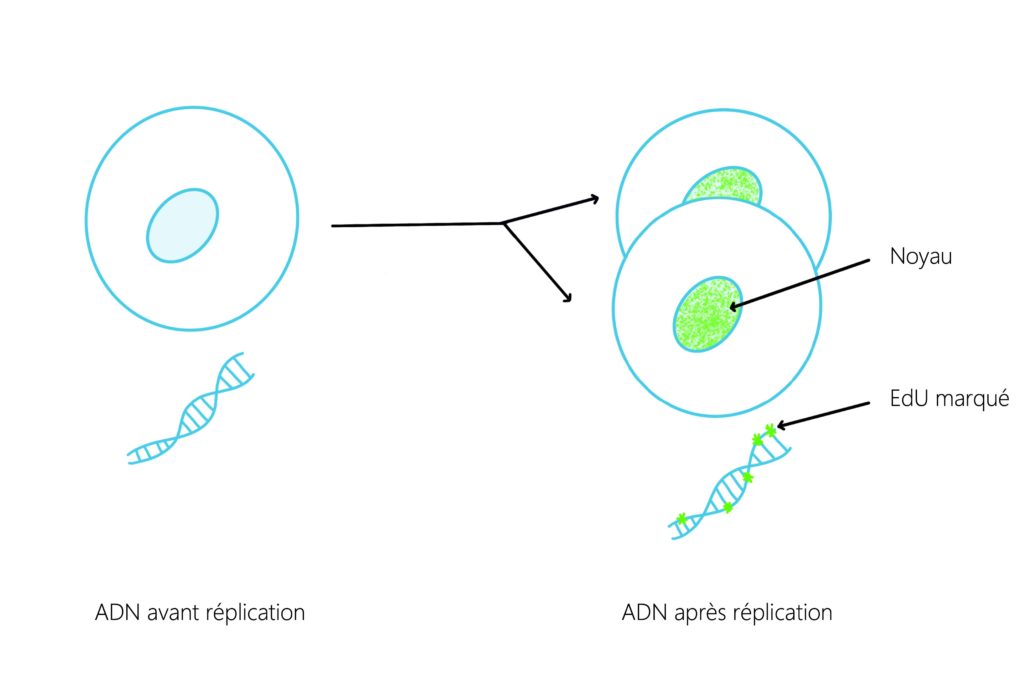
Pour cela, les chercheur·ses ont tenté de suivre la multiplication cellulaire au niveau des zones de formation des tentacules en utilisant la microscopie confocale. Il s’agit d’un type de microscopie permettant la détection et la distinction de molécules fluorescentes sur une couche mince de tissu, permettant de déterminer si deux protéines se trouvent au même endroit. Pour cela, toutes les cellules du tissu sont d’abord mises en évidence grâce au marquage de leur noyau. Il suffit de colorer l’ADN contenu dans chacun d’eux en bleu. Ensuite, pour distinguer spécifiquement les cellules qui prolifèrent, l’équipe a utilisé des bases nucléiques (= composants de l’ADN) modifiées. Dans ce cas précis, c’est l’EdU, une molécule ressemblant à la base thymine (T) qui est incorporée dans la double hélice de l’ADN des cellules. Cette incorporation a lieu lors de la réplication, c’est-à-dire au moment de la copie de l’ensemble du matériel génétique qui se déroule avant la division cellulaire. Si la cellule ne se divise pas, l’EdU ne peut pas s’incorporer dans l’ADN. En revanche, si la fréquence de division cellulaire est élevée, alors beaucoup de cellules nouvellement formées incorporent de l’EdU. Par la suite, une molécule fluorescente qui a comme propriété de se fixer spécifiquement à l’EdU est ajoutée dans l’environnement de Stella. Les cellules qui se sont divisées deviennent alors visibles en microscopie confocale (Figure 3) [1].
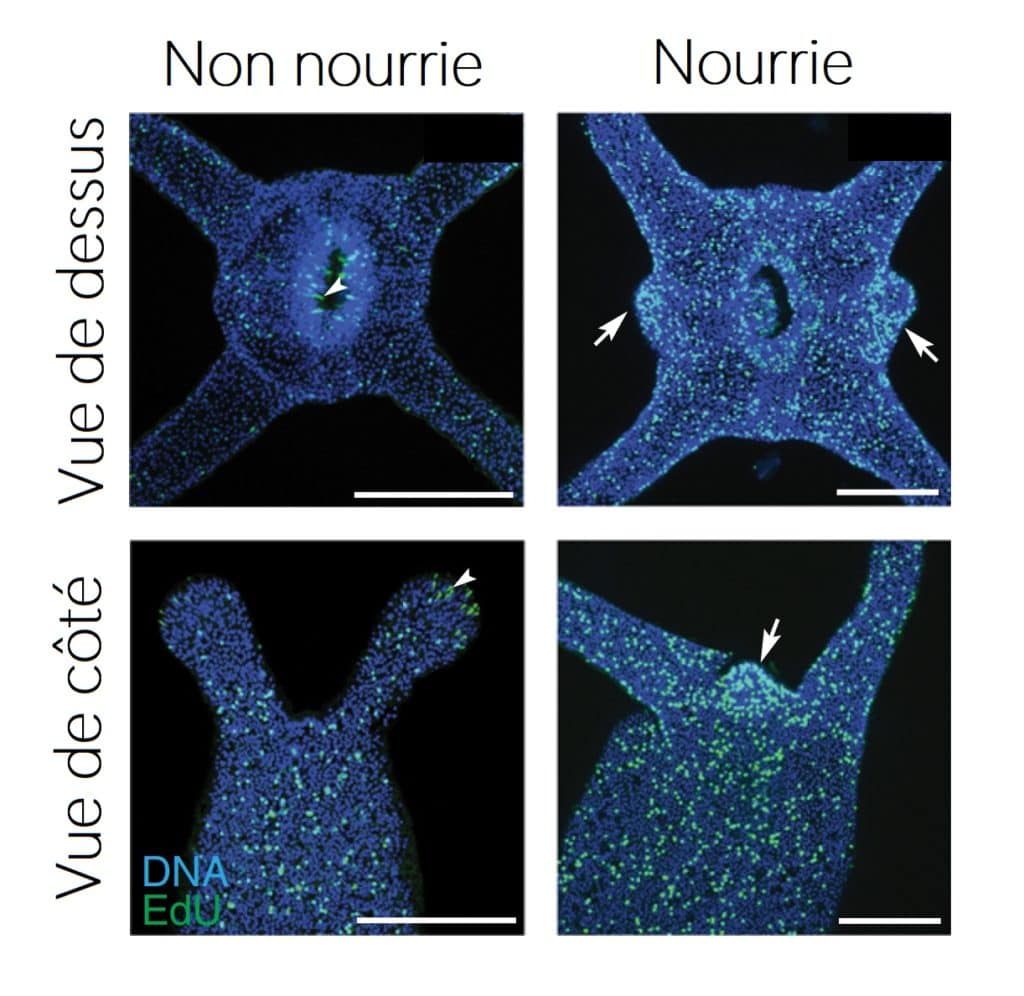
Les images obtenues grâce à cette technique (Figure 4) permettent de distinguer l’apparition de nouvelles cellules lorsque Stella est nourrie et ce, de manière plus importante au niveau de petites zones autour de la bouche-anus : ce sont les bourgeons des tentacules. Dans le contexte de la croissance des tentacules, la prolifération cellulaire y est donc très active.
Dessert : pièce montée moléculaire
L’équipe d’Aissam Ikmi est maintenant à la recherche des acteurs moléculaires qui initieraient la formation de bourgeons de tentacules, et a en ligne de mire une protéine très particulière : la protéine TOR.
Chez les mammifères, la protéine TOR joue deux rôles complémentaires : un rôle de capteur de l’apport alimentaire et un autre d’inducteur de la croissance des tissus [2]. L’équipe a donc cherché à vérifier si TOR était présente et exerçait cette même fonction dans le développement des tentacules chez Stella. À la surprise des scientifiques et bien que très éloignée des mammifères d’un point de vue de parenté, Stella produit bien la protéine TOR. Mais ce n’est pas tout ! L’activation de cette dernière est accrue au niveau des bourgeons quand Stella est nourrie (Figure 5).
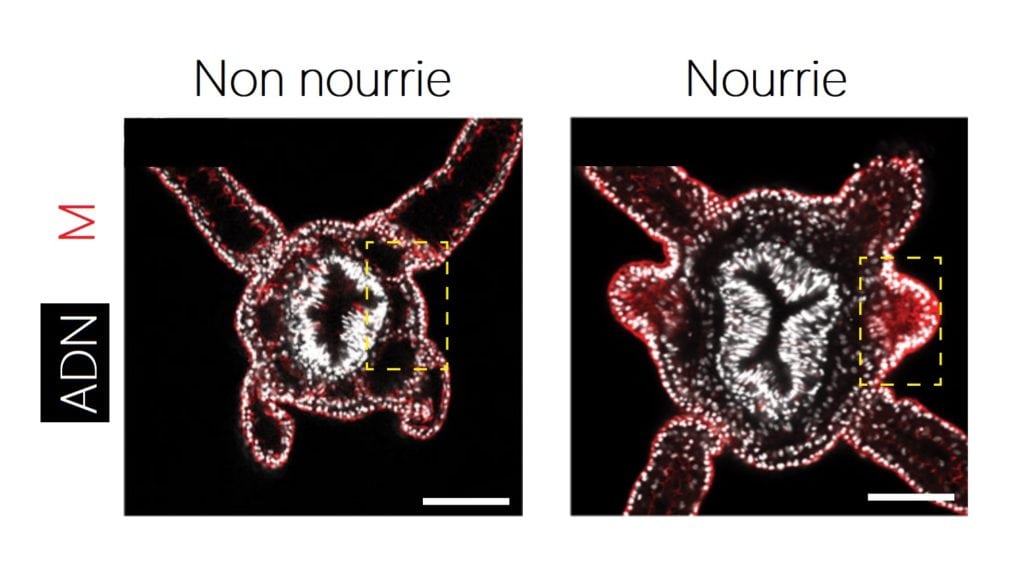
Ainsi, TOR serait activée lorsque Stella est rassasiée et commencerait à initier la prolifération cellulaire et donc la croissance des tissus qui vont constituer les tentacules. TOR possède donc très probablement un rôle dans le contrôle de la croissance des bras tentaculaires de Stella.
Remarquez comme la molécule active est plus spécifiquement localisée au niveau des bourgeons ! Les scientifiques s’en sont également aperçus et se sont alors interrogés sur la raison de cette localisation précise. Dans de précédentes recherches, la présence, dans les tentacules en développement, d’un interrupteur moléculaire connu pour induire la croissance de cellules avait été décrite. Il s’agit du récepteur FGFRb [3]. Les chercheur·ses ont mis en évidence sa présence dans des petits groupes de cellules situés à la périphérie de la bouche-anus. Lorsqu’iels ont nourri Stella, la quantité de FGFRb détectée au sein de ces petits groupes a augmenté. C’est notamment à ces endroits précis que se forment ensuite les bourgeons de tentacules.
Pour tester l’hypothèse que l’augmentation de la quantité de FGFRb serait due à l’activité de TOR, les chercheur·ses ont traité Stella avec une substance bloquant l’action de TOR (Figure 6). S’il y a vraiment implication de TOR, alors en la bloquant, FGFRb ne sera pas produit et ne pourra donc pas être détecté. Et effectivement, les chercheur·ses observent une quantité très faible de FGFRb ainsi qu’une absence de formation de bourgeons de tentacules quand TOR est bloquée.
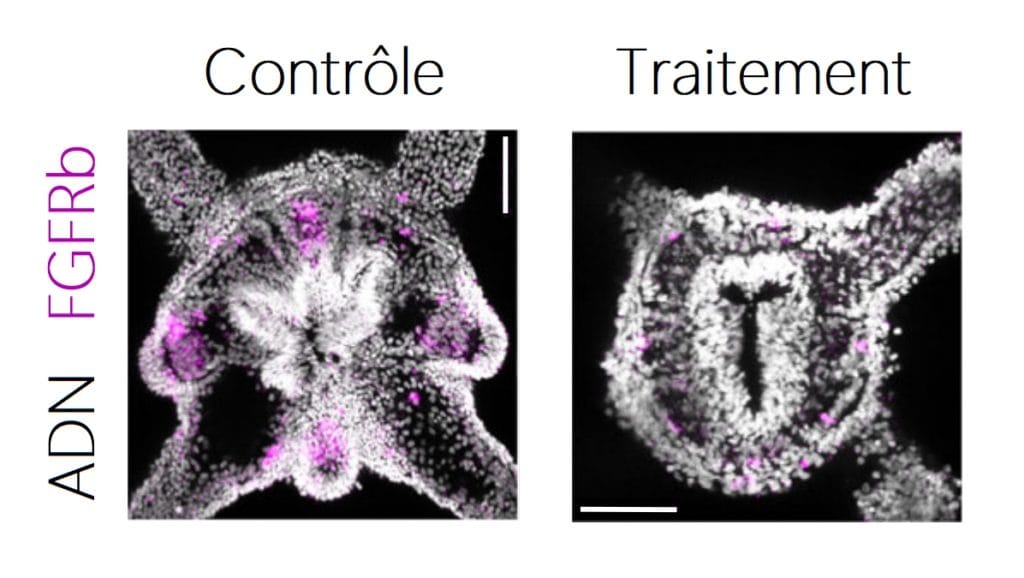
Cela a permis à l’équipe de recherche de comprendre que les régions de bourgeonnement sont prédéterminées par la présence de FGFRb. Lorsque Stella se nourrit, TOR est activée dans ces cellules et vient augmenter la quantité de FGFRb dans les cellules voisines. Cette action en cascade permet la mise en place des bourgeons (Figure 7).
Un café et l’addition
Au cours de cette étude, les chercheur·ses ont montré que lorsque Stella mange, ses cellules réagissent en se multipliant. Cette multiplication résulte notamment de la coopération entre le récepteur FGFRb et la molécule TOR. Ce mécanisme conduit à la formation séquentielle des nouveaux tentacules chez notre tendre amie Stella.
En réalité, pour Stella, il serait donc plus juste de dire « pas de chocolat, pas de bras » !
Éléments pour approfondir
Digestif : assortiment de tentacules
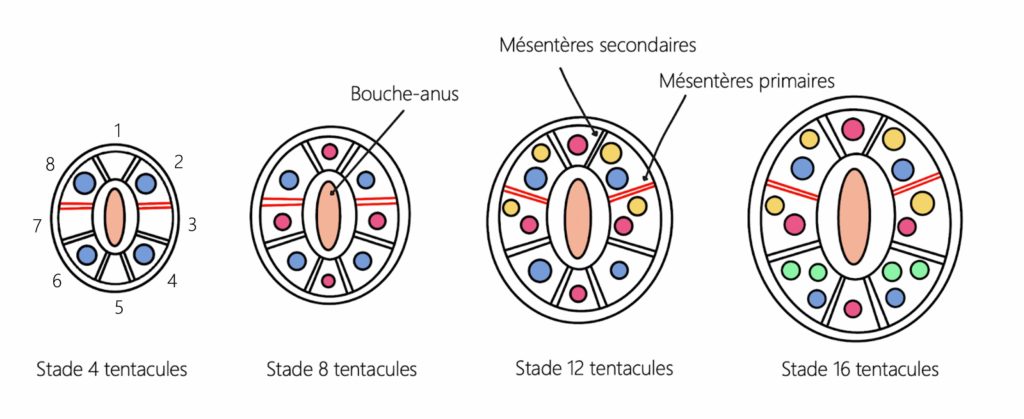
Autour de la bouche-anus, nous distinguons huit compartiments distincts. Ces compartiments sont séparés par des structures appelées mésentères (du grec mesos « milieu » et enteron « intestin »), qui se situent tout le long de l’anémone. Notons que les mésentères ont plusieurs rôles dont le stockage des cellules reproductrices. Les tentacules sont positionnés autour de la bouche-anus. Une jeune anémone en a quatre.
Les quatre premiers tentacules, les tentacules primaires, émergent à partir des compartiments 2, 4, 6 et 8 (Figure 8). Quand Stella se restaure, deux autres paires de tentacules sont générées parallèlement à partir des compartiments 3 et 7 puis 1 et 5. À cette étape, Stella possède un tentacule par compartiment. Ensuite, quatre tentacules apparaissent dans les compartiments de part et d’autre des mésentères primaires. Enfin, pour atteindre le stade de seize tentacules, deux d’entre eux sont générés dans le compartiment 4 puis deux autres dans le compartiment 6 ou inversement. Nous allons nous arrêter là, car oui, elle peut en faire pousser encore plus !
L’équipe de recherche a pu observer ce type de développement des tentacules chez 80 % des camarades de Stella. Cependant, 20 % sont un peu plus originaux concernant ce processus, originalité que les auteurs et autrices ont attribué à une variation génétique et des différences dans leur manière de manger.
[1] Diermeier-Daucher S., et al., Cell type specific applicability of 5-ethynyl-2′-deoxyuridine (EdU) for dynamic proliferation assessment in flow cytometry. Cytometry Part A, 2009. DOI : 10.1002/cyto.a.20712. [Publication scientifique]
[2] Laplante M. & Sabatini D. M., mTOR Signaling in Growth Control and Disease. Cell, 2012. DOI : 10.1016/j.cell.2012.03.017. [Review]
[3] Matus D. Q., et al., FGF signaling in gastrulation and neural development in Nematostella vectensis, an anthozoan cnidarian. Development Genes and Evolution, 2007. DOI : 10.1007/s00427-006-0122-3. [Publication scientifique]
Contributeur écriture initiale : Szymon Chomiczewski