Chargement de l'article...
Écriture : Aurélien Schwob
Relecture scientifique : Eléonore Pérès
Relecture de forme : Agathe Pralus et Lucile Riaboff
Temps de lecture : environ 12 minutes.
Thématiques : Immunologie et Microbiologie (Biologie)
Publication originale : Shankar E. M., et al., Expression of a Broad Array of Negative Costimulatory Molecules and Blimp-1 in T Cells following Priming by HIV-1 Pulsed Dendritic Cells. Molecular Medicine, 2010. DOI : 10.2119/molmed.2010.00175
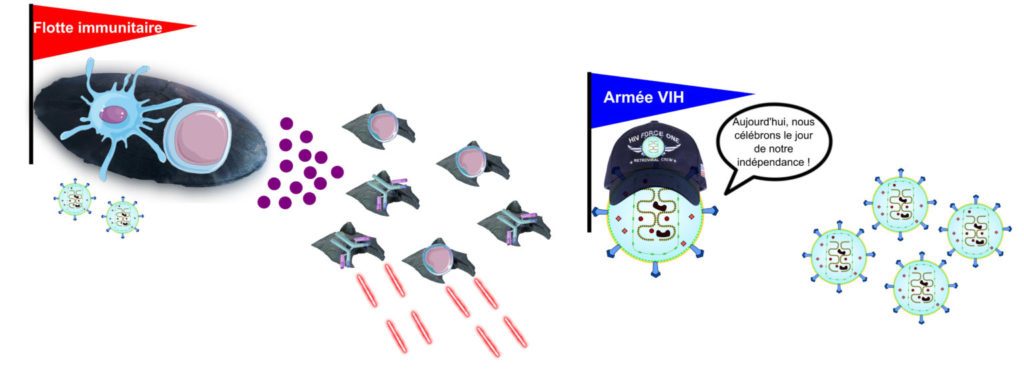
Dans leur article paru en 2011, l’équipe du Dr. Marie Larsson a ajouté une importante pierre à l’édifice de la compréhension de la dépression du système immunitaire qui fait suite à l’infection par le VIH. Ces chercheurs ont mis en évidence un véritable scénario Hollywoodien, dans lequel des particules du VIH, à l’image des héros du film Independence Day, s’introduisent dans les cellules immunitaires pour saboter la coordination du système immunitaire, causant sa perte.
Quoi de plus terrifiant qu’un ennemi savamment organisé et méthodique, capable de coordonner ses forces pour vous combattre ? Dans le film Independence Day de Michael Bay sorti en 1996, l’humanité affronte une invasion Alien implacable de par la coordination de ses forces. La seule issue à cette impasse trouvée par les héros du film est alors de perturber la parfaite mécanique de l’armée Alien au moyen d’un virus informatique. Dans son article paru en 2011, l’équipe de Marie Larsson a participé à la démonstration que le VIH, le Virus de l’Immunodéficience Humaine, responsable du SIDA [*], ne s’y prend pas autrement que les héros d’Independence Day. Leurs travaux montrent en effet que le VIH est capable d’interférer avec la capacité de coordination du système immunitaire, qui joue ici le rôle des Aliens, pour lui échapper…
Le système immunitaire : une machine de guerre implacable et diablement bien organisée !
Dans Independence Day, l’humanité est incapable de lutter contre l’impressionnante armée Alien à laquelle elle doit faire face. Cette dernière comporte de nombreux vaisseaux positionnés sur des points stratégiques partout dans le monde, capables de libérer des chasseurs et des bombardiers. Le tout est coordonné par un vaisseau-mère en orbite, hors d’atteinte d’une action d’ampleur. Cette description fait froid dans le dos, tant on sait d’expérience qu’il est presque impossible de défaire une armée bien organisée.
Pour se rassurer, il faut nous dire que notre système immunitaire fait partie de ces organisations implacables et incroyablement bien coordonnées. Ses bombardiers et ses chasseurs sont les anticorps, capables de neutraliser les pathogènes présents dans le sang et dans les liquides extra-cellulaires, ainsi que les lymphocytes T8, dont la tâche est de débusquer les pathogènes réfugiés à l’intérieur même des cellules. Ses vaisseaux-mères sont les lymphocytes T4, véritables chef-d’orchestres, coordonnant d’une main de maître les opérations. Les lymphocytes T4 sont opérationnels en moins de quelques jours après l’entrée du pathogène. Un dernier acteur, les cellules dendritiques, permettent l’activation des lymphocytes T4. Les cellules dendritiques sont infatigables sentinelles patrouillent sans relâche dans l’organisme et sont capables de détecter et de capturer les intrus, avant de les présenter aux lymphocytes n’ayant pas encore été activés qui rongent leurs freins dans les ganglions lymphatiques.
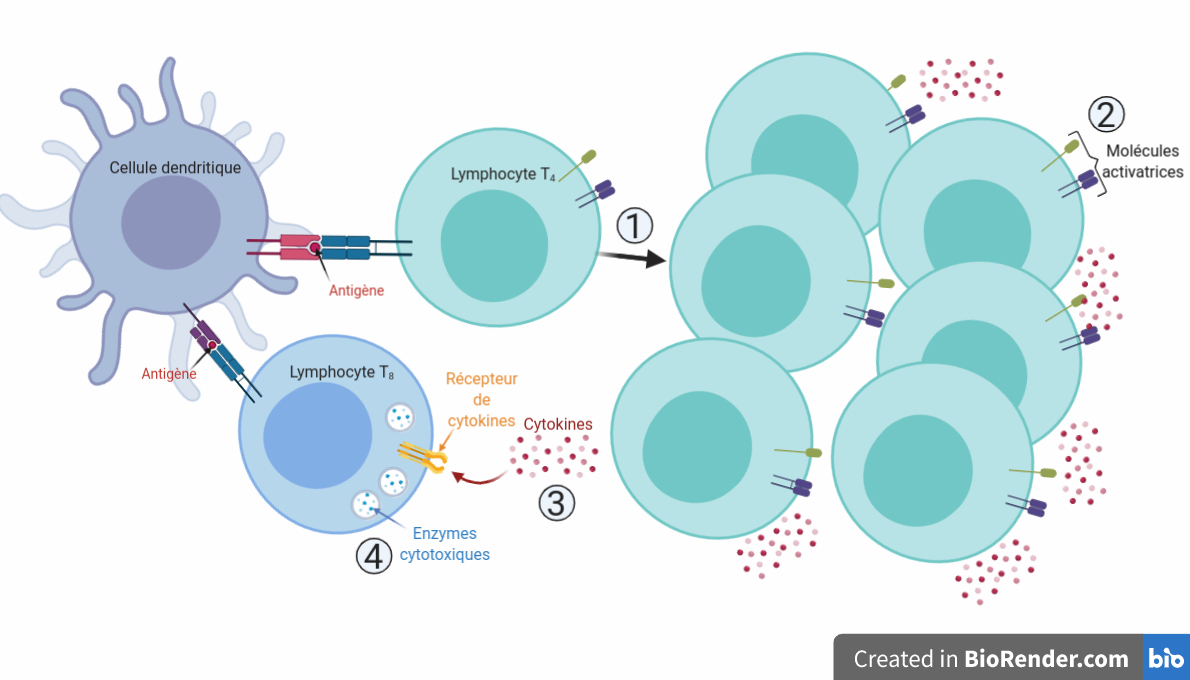
Une bonne activation des lymphocytes T4 par les cellules dendritiques implique quatre éléments permettant l’efficacité de la réponse immunitaire (Figure 1) :
- Tout d’abord, le lymphocyte T4, une fois activé, prolifère et se multiplie pour donner de nombreux autres lymphocytes T4 activés (point 1 de la Figure 1).
- Chacun de ces lymphocytes présente à sa surface des molécules activatrices, permettant une activation « au contact » (point 2 de la Figure 1). Par ces contacts directs avec une autre cellule, les lymphocytes T4 coordonnent précisément la réponse immunitaire, en sélectionnant « en personne » chaque acteur de cette réponse.
- Les lymphocytes produisent également de nombreuses cytokines, des messagers permettant une activation « à distance » (point 3 de la Figure 1). Cela permet notamment d’augmenter l’efficacité de la réponse : une fois les acteurs sélectionnés au contact, il est plus simple de les stimuler à distance, une fois ces lymphocytes partis « en mission ».
- Tous ces signaux permettent par exemple d’activer des lymphocytes T8. Ceux-ci produisent alors de nombreuses enzymes, qui sont les munitions avec lesquelles les lymphocytes T8 détruisent les cellules infectées par les pathogènes (point 4 de la Figure 1).
Des failles dans le système…
Seulement voilà, l’expérience montre que certaines infections sont à même de se jouer du système immunitaire. C’est pour cette raison que l’on observe des infections chroniques avec des virus capables de rester dans un même organisme sur le long terme, sans que le système immunitaire ne soit en mesure de l’éradiquer, comme c’est le cas du VIH. Dès le début des années 2000, des études ont montré que l’infection par le VIH s’accompagnait d’une très faible efficacité des lymphocytes T4 [1]. Notons bien qu’il ne s’agit pas, comme on le pense souvent, uniquement d’une destruction des lymphocytes suite à leur infection par le VIH, mais bien d’une perte d’efficacité et d’une diminution du nombre de lymphocytes présents dans l’organisme, sans que cela ne se limite aux lymphocytes directement détruits par le VIH.
Tester l’hypothèse Independence Day
Comment le VIH s’y prend-il pour désorganiser ainsi le système immunitaire ? Les cellules dendritiques ont pour rôle d’activer les lymphocytes T4. Or, des observations indiquent la présence du VIH dans ces cellules dendritiques. Cela a mis la puce à l’oreille de Marie Larsson et de son équipe de l’université Suédoise de Linköping. Et si, à l’image des héros d’Independence Day qui introduisent un virus informatique dans le vaisseau-mère Alien pour désorganiser leur armée, le VIH était capable de perturber l’activation du système immunitaire depuis l’intérieur même des cellules dendritiques ?
Dans leur étude publiée en 2011, qui a fait partie des publications majeures dans l’exploration in vitro de cette problématique, l’équipe de Marie Larsson a utilisé un protocole simple en apparence. Ils ont obtenu des cellules dendritiques à partir de cellules sanguines de patients sains qu’ils ont artificiellement activées. Ils ont ensuite mis ces cellules en présence de particules du VIH, c’est-à dire en présence des entités du virus VIH telles qu’il se présente à l’extérieur des cellules. Ils ont pris soin d’utiliser des doses de virus correspondant à des quantités retrouvées chez les patients infectés par le VIH. Après avoir mis ces cellules dendritiques en contact avec le virus, il ont récupéré ces cellules et les ont isolées du virus. Ils ont ensuite mis ces cellules dendritiques en présence de lymphocytes T4 naïfs, de manière à voir si ces lymphocytes étaient correctement activés. En guise de témoin, chaque analyse était comparée à des lymphocytes T4 mis en présence de cellules dendritiques qui n’avaient pas été préalablement mises en contact avec le VIH. À la suite de ce protocole, ils ont eu le loisir de tester tous les paramètres d’activation que nous avons évoqués plus tôt : prolifération, production de messages activateurs de contact et à distance et capacité à faire produire à des lymphocytes T8 des enzymes permettant de détruire des cellules infectées (Figure 1).
Des lymphocytes en sous-nombre après leur activation par des cellules dendritiques ayant croisé le VIH…
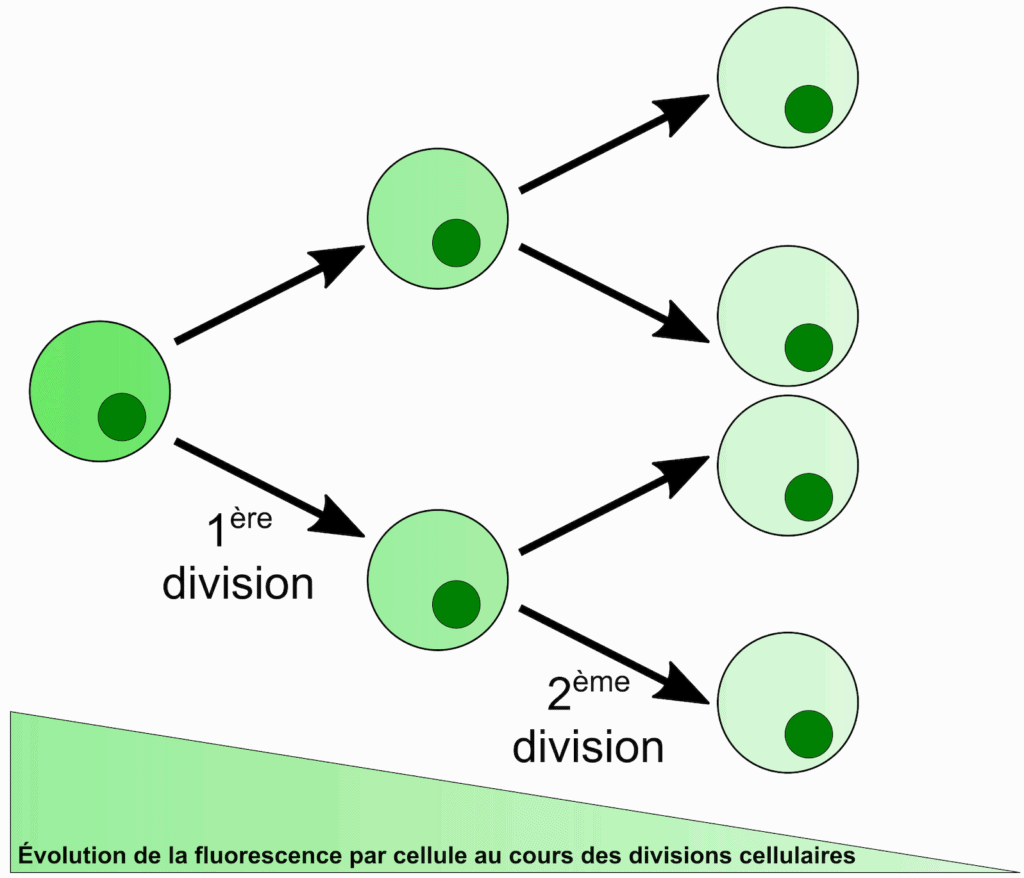
La prolifération des lymphocytes T4 a tout d’abord été étudiée grâce à une technique par fluorescence qui quantifie le nombre de divisions cellulaires réalisées par une cellule en un temps donné (Figure 2). Cette technique permet d’observer que les lymphocytes ayant fortement proliféré sont entre 20 et 60 % moins nombreux lorsqu’ils ont été activés par des cellules dendritiques préalablement mises en contact avec des particules du VIH, que lorsqu’ils ont été activés par des cellules dendritiques n’ayant croisé la route d’aucun virus. Il est à noter que l’espérance de vie de ces lymphocytes ne semble pas être affectée par ce processus. Le contact avec le VIH diminue donc la capacité des cellules dendritiques à induire la multiplication des lymphocytes T4, ce qui peut expliquer la plus faible efficacité du système immunitaire (Figure 3B – point 1).
… et une efficacité des lymphocytes qui n’est pas au rendez-vous !
Ne s’arrêtant pas en si bon chemin, l’équipe de chercheurs continue la caractérisation des paramètres de l’activation du système immunitaire, en testant les fonctions des lymphocytes T4 activés par des cellules dendritiques ayant fricoté avec le VIH. Après tout, si ces cellules sont très efficaces, cela pourrait suffire, malgré leur faible effectif, à lutter contre le virus !
Dans le but de répondre à cette question et d’estimer la capacité de lymphocytes T4 à activer le système immunitaire, les chercheurs ont étudié les signaux d’activation « au contact » présents à la surface de ces lymphocytes T4. Ils ont observé que les lymphocytes T4 activés par des cellules dendritiques préalablement mises en contact avec des particules du VIH présentent de nombreuses protéines qui ont une activité inhibitrice sur le système immunitaire, c’est-à-dire qu’elles vont ralentir la réponse immunitaire au lieu de l’activer (Figure 3B – point 2) !
Ces données montrent donc que non seulement le VIH réduit la capacité des cellules dendritiques à induire la multiplication les lymphocytes T4, mais qu’en plus, le peu de lymphocytes qui prolifèrent sont porteurs de molécules qui vont inhiber, et non pas activer le système immunitaire. Il semblerait donc que l’incursion des saboteurs du VIH au sein du système immunitaire empêche ce dernier de remplir efficacement sa tâche.
Une issue prévisible
Et comme dans un film Hollywoodien cousu de fil blanc, la suite de l’analyse des paramètres d’activation du système immunitaire ne révèle pas de surprise majeure. Les lymphocytes T4 activés par des cellules dendritiques ayant été infiltrées par le VIH produisent drastiquement moins de cytokines (Figure 3B – point 3). Or, ce sont des molécules d’activation à distance du système immunitaire. On en déduit donc que cette capacité d’activation est inhibée.
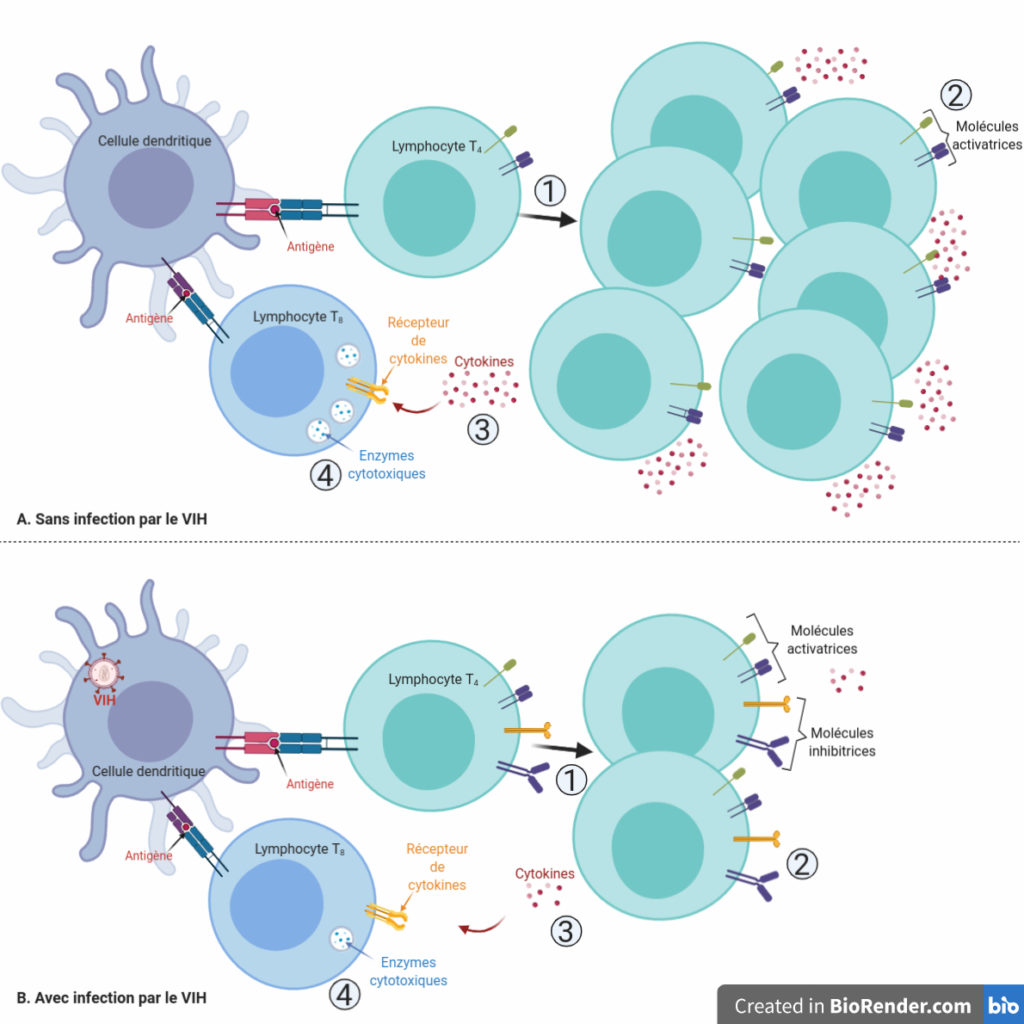
Avec la baisse du nombre de lymphocytes T4, la présence de marqueurs inhibiteurs à leur surface ainsi que la baisse de leur production de cytokines activatrices, il y a fort à craindre que l’analyse des lymphocytes T8 ne révèle pas une activité très élevée. Pour déterminer cela, les chercheurs ont analysé, dans les lymphocytes T8, la présence des enzymes responsables de la mort des cellules infectées. Cette approche montre une importante baisse de la quantité de deux de ces enzymes (Figure 3B – point 4). Cela engendre une inhibition de la fonction des lymphocytes T8, en première ligne dans la lutte contre les infections virales comme le VIH, de par leur action de destruction des cellules infectées. Cette inhibition est une conséquence de la perte d’efficacité globale des fonctions des lymphocytes T4, dont on a pu voir que tous les paramètres d’activation étaient méthodiquement sabotés par l’action du VIH (Figure 3).
La nécessité d’un Grenelle de l’immunité ?
Cette étude a constitué un jalon majeur dans la compréhension de l’immunodéficience causée par l’infection par le VIH. En effet, elle montre que les particules virales du VIH, capables d’infiltrer les cellules dendritiques, perturbent ainsi l’activation des lymphocytes T4 par ces mêmes cellules dendritiques. Les lymphocytes T4, moins nombreux et moins efficaces (au contact comme à distance), ne parviennent pas à coordonner le reste de l’arsenal immunitaire, lymphocytes T8 en tête.
Cette étude a le principal défaut d’être réalisée exclusivement in vitro, impliquant des cellules dendritiques activées artificiellement, des virus ne reflétant pas la diversité des particules virales présentes lors d’une réelle infection ou encore des conditions de contact entre virus et cellules dont on ne peut pas certifier qu’elles correspondent à ce qui a lieu chez les patients. Mais en gardant toutes ces limites à l’esprit, l’importance de cette étude résidait à l’époque de sa parution dans sa cohérence avec les observations réalisées sur des cellules immunitaires de patients SIDA. Elle a depuis permis d’orienter de nombreuses études in vivo qui ont confirmé ce mécanisme [2].
À l’image des Aliens d’Independence Day, l’immunité paie cher la rigueur de son organisation, dont l’acteur central est le lymphocyte T4, dûment activé par une cellule dendritique. Cette centralisation du rôle de coordination par ces cellules, qui est à l’origine de l’efficacité du système immunitaire et de la relative facilité avec laquelle on peut l’exploiter — notamment par le biais de la vaccination — est aussi son point faible. Une fois que ce maillon a cédé, c’est en effet l’intégralité de la chaîne qui s’effondre inexorablement, comme cela est malheureusement le cas des patients infectés par le VIH.
Alors que faire ? Est-il possible d’utiliser ces données pour envisager des thérapies contre le SIDA ? C’est ce qui a été entrepris, notamment sur la base de cette étude de 2011, en essayant de bloquer les fameux marqueurs inhibiteurs situés à la surface des lymphocytes T4 activés par des cellules dendritiques sabotées par le VIH. Ces thérapies ciblent notamment la protéine PD-1, inhibiteur majeur de l’action des lymphocytes T4 et dont le rôle dans la dépression immunitaire est bien connu [3]. La compréhension de ce dysfonctionnement peut nous permettre d’envisager de réformer l’administration immunitaire, de manière à le rendre insensible à ce genre d’actions. Et ainsi espérer, peut-être, sur le long terme, d’entrevoir le jour de notre indépendance vis-à-vis du SIDA.
[*] SIDA : le Syndrome d’ImmunoDéficience Acquise est le nom donné à la dernière phase de l’infection d’un patient humain par le Virus de l’Immunodéficience Humaine (VIH). Cette phase est caractérisée par une immunodéficience, c’est-à-dire l’incapacité du système immunitaire à fonctionner correctement et à défendre l’organisme contre les agents infectieux et les dangers internes (cancer notamment). L’immunodéficience est dans ce cas la conséquence de l’infection par le VIH, qui va empêcher le bon fonctionnement du système immunitaire de plusieurs façons.
[1] Weiss L., et al., Human immunodeficiency virus-driven expansion of CD4+CD25+ Tregs, which suppress HIV-specific CD4 T-cell responses in HIV-infected patients. Blood, 2004. DOI : 10.1182/blood-2004-01-0365. [Publication scientifique]
[2] Mylvaganam G. H., et al., Combination anti-PD-1 and antiretroviral therapy provides therapeutic benefit against SIV. JCI Insight, 2018. DOI : 10.1172/jci.insight.122940. [Publication scientifique]
[3] Day C. L., et al., PD-1 expression on HIV-specific T cells is associated with T-cell exhaustion and disease progression. Nature, 2006. DOI : 10.1038/nature05115. [Publication scientifique]
Écriture : Aurélien Schwob
Relecture scientifique : Eléonore Pérès
Relecture de forme : Agathe Pralus
Temps de lecture : environ 16 minutes.
Thématiques : Immunologie et Microbiologie (Biologie)
Publication originale : Shankar E. M., et al., Expression of a Broad Array of Negative Costimulatory Molecules and Blimp-1 in T Cells following Priming by HIV-1 Pulsed Dendritic Cells. Molecular Medicine, 2010. DOI : 10.2119/molmed.2010.00175

Dans leur article paru en 2011, l’équipe du Dr. Marie Larsson a ajouté une importante pierre à l’édifice de la compréhension de la dépression du système immunitaire qui fait suite à l’infection par le VIH. Ces chercheurs ont mis en évidence un véritable scénario Hollywoodien, dans lequel des particules du VIH, à l’image des héros du film Independence Day, s’introduisent dans les cellules immunitaires pour saboter la coordination du système immunitaire, causant sa perte.
Quoi de plus terrifiant qu’un ennemi savamment organisé et méthodique, capable de coordonner ses forces pour vous combattre ? Dans le film Independence Day de Michael Bay sorti en 1996, l’humanité affronte une invasion Alien implacable de par la coordination de ses forces. La seule issue à cette impasse trouvée par les héros du film est alors de perturber la parfaite mécanique de l’armée Alien au moyen d’un virus informatique. Dans son article paru en 2011, l’équipe de Marie Larsson a participé à la démonstration que le VIH, le Virus de l’Immunodéficience Humaine, responsable du SIDA [*], ne s’y prend pas autrement que les héros d’Independence Day. Leurs travaux montrent en effet que le VIH est capable d’interférer avec la capacité de coordination du système immunitaire, qui joue ici le rôle des Aliens, pour lui échapper…
Le système immunitaire : une machine de guerre implacable et diablement bien organisée !
Dans Independence Day, l’humanité est incapable de lutter contre l’impressionnante armée Alien à laquelle elle doit faire face. Cette dernière comporte de nombreux vaisseaux positionnés sur des points stratégiques partout dans le monde, capables de libérer des chasseurs et des bombardiers. Le tout est coordonné par un vaisseau-mère en orbite, hors d’atteinte d’une action d’ampleur. Cette description fait froid dans le dos, tant on sait d’expérience qu’il est presque impossible de défaire une armée bien organisée.
Pour se rassurer, il faut nous dire que notre système immunitaire est de ces organisations implacables et incroyablement bien coordonnées. Ses bombardiers et ses chasseurs sont les anticorps, capables de neutraliser les pathogènes présents dans le sang et les liquides extra-cellulaires, ainsi que les lymphocytes T8 dont la tâche est de débusquer les pathogènes réfugiés à l’intérieur même des cellules. Ses vaisseaux-mères sont les lymphocytes T4, véritables chef-d’orchestres, coordonnant de main de maître les opérations. Les lymphocytes T4 sont opérationnels en moins de quelques jours après l’entrée du pathogène. Un dernier acteur, les cellules dendritiques, permettent l’activation des lymphocytes T4. Ces infatigables sentinelles patrouillent sans relâche dans l’organisme et sont capables de détecter et de capturer les intrus. Des fragments de ces intrus (appelés antigènes) sont ensuite présentés aux lymphocytes naïfs (n’ayant pas encore été activés) qui rongent leurs freins dans les ganglions lymphatiques.
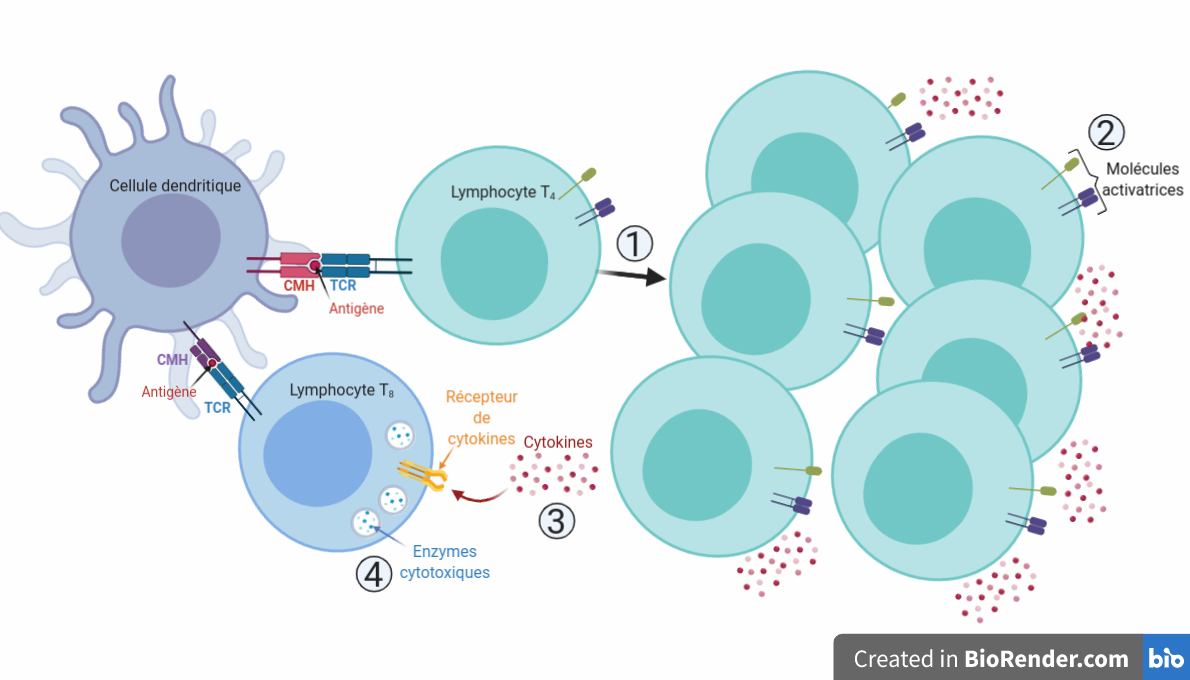
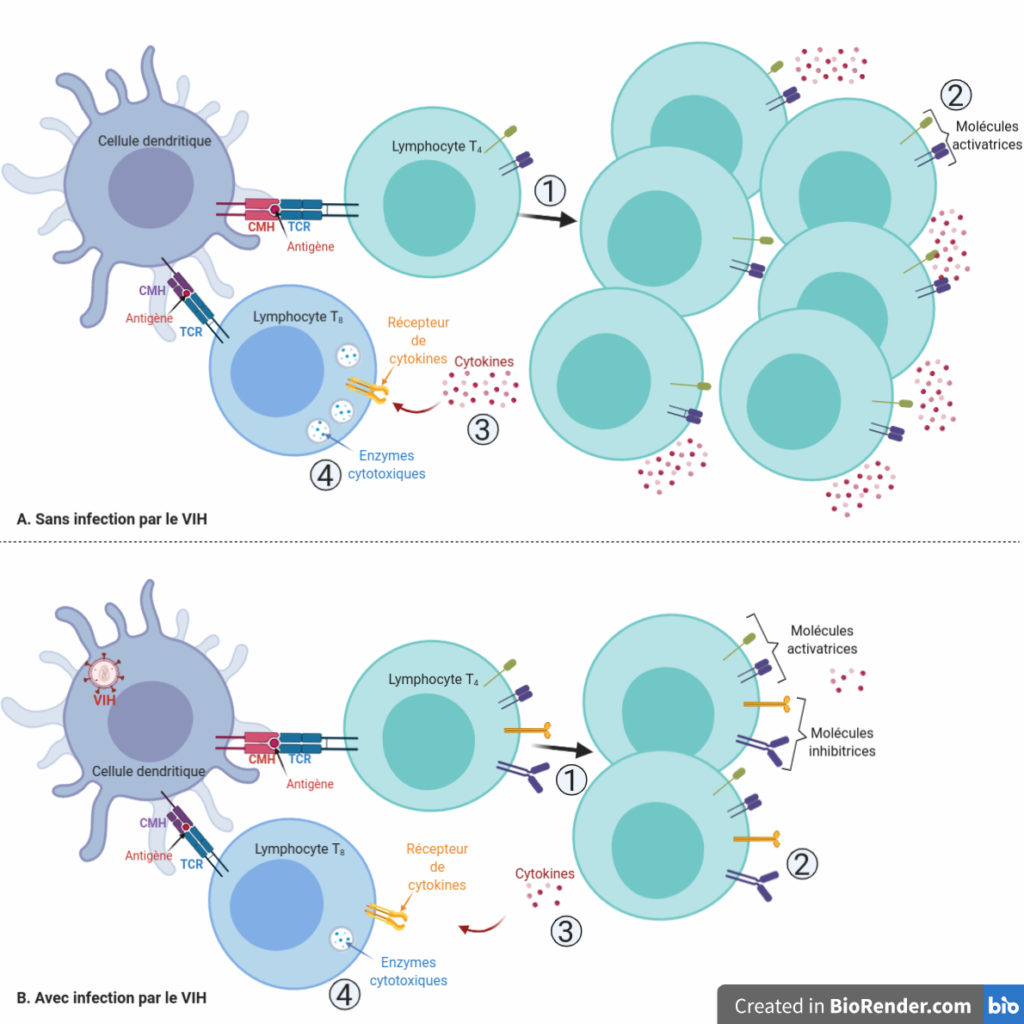
Une bonne activation des lymphocytes T4 par les cellules dendritiques implique quatre éléments permettant l’efficacité de la réponse immunitaire (Figure 1). Tout d’abord, le lymphocyte T4 une fois activé prolifère et se multiplie pour donner de nombreux lymphocytes T4 activés. Chacun de ces lymphocytes présente à sa surface des molécules activatrices qui activent des cellules-cibles « au contact ». Cette activation passe, dans ces cibles, par une cascade de signalisation. Les lymphocytes produisent également de nombreuses cytokines, des messagers permettant une activation « à distance ». Tous ces signaux permettent par exemple d’activer des lymphocytes T8, qui vont produire de nombreuses enzymes cytotoxiques (= qui sont capables de provoquer la mort des cellules). Ces enzymes sont les munitions avec lesquelles les lymphocytes T8 vont détruire les cellules infectées par les pathogènes.
Des failles dans le système…
Seulement voilà, l’expérience montre que certaines infections sont à même de se jouer du système immunitaire. Par exemple, certains virus sont capables d’établir des infections chroniques, c’est-à-dire de rester dans un même organisme sur le long terme sans que le système immunitaire ne soit en mesure de l’éradiquer, comme c’est le cas du VIH [1]. Dès le début des années 2000, des études ont montré que l’infection par le VIH s’accompagnait d’une très faible efficacité des lymphocytes T4 [2]. Notons bien qu’il ne s’agit pas, comme on le pense souvent, uniquement d’une destruction des lymphocytes suite à leur infection par le VIH, mais bien d’une perte d’efficacité et d’une diminution du nombre de lymphocytes présents dans l’organisme, infectés ou non.
Tester l’hypothèse Independence Day
Comment le VIH s’y prend-il pour désorganiser ainsi le système immunitaire ? Des données indiquant la présence du VIH dans les cellules dendritiques obtenues dans leur laboratoire ont mis la puce à l’oreille de Marie Larsson et de son équipe de l’université Suédoise de Linköping [3]. Or ces données sont importantes, quand on connaît le rôle important des cellules dendritiques dans l’activation du système immunitaire. Et si, à l’image des héros d’Independence Day qui vont introduire un virus informatique dans le vaisseau-mère Alien pour désorganiser leur armée, le VIH était capable de perturber l’activation du système immunitaire depuis l’intérieur même des cellules dendritiques ?
Dans leur étude publiée en 2011, qui a fait partie des publications majeures dans l’exploration in vitro de cette question, l’équipe de Marie Larsson a utilisé un protocole simple en apparence. Les chercheurs ont obtenu des cellules dendritiques à partir de cellules sanguines de patients sains qu’ils ont artificiellement activées. Ils ont ensuite mis ces cellules en présence de particules du VIH (appelées virions) en prenant soin d’utiliser des doses de virus correspondant à des quantités retrouvées chez les patients. Après avoir mis ces cellules dendritiques en contact avec le virus, il ont récupéré ces cellules, évacué le virus, et mis les cellules dendritiques en présence de lymphocytes T4 naïfs, de manière à voir si ces lymphocytes étaient correctement activés. En guise de témoin, chaque analyse était comparée à des lymphocytes T4 mis en présence de cellules dendritiques qui n’avaient pas été préalablement mises en contact avec des virions du VIH. À la suite de ce protocole, ils ont ensuite eu le loisir de tester tous les paramètres d’activation que nous avons évoqués plus tôt : prolifération, production de messages activateurs de contact et à distance et capacité à faire produire des enzymes cytotoxiques à des lymphocytes T8 (Figure 1).
Des lymphocytes en sous-nombre après leur activation par des cellules dendritiques ayant croisé le VIH…
La prolifération des lymphocytes T4 a tout d’abord été étudiée. Cela a pu se faire grâce à une technique dont le principe est enfantin : faire tremper les cellules dans un milieu riche en molécules fluorescentes (fluorophores), qui entrent facilement dans les cellules mais en sortent difficilement. Une fois remises dans un milieu sans molécules fluorescentes, la fluorescence de chaque cellule dépend de la quantité de fluorophores qu’elle contient. Or, si la cellule se divise, ces molécules se répartissent entre les deux cellules-filles, qui sont donc chacune à peu près deux fois moins fluorescentes ! Après deux divisions, l’intensité de fluorescence de chaque cellule est divisée par quatre, et ainsi de suite (Figure 2). Ainsi, la fluorescence d’une cellule est inversement proportionnelle au nombre de divisions qu’elle a subi depuis son extraction du milieu fluorescent.

L’utilisation de cette technique a permis de mettre en évidence des lymphocytes T4 ayant vu significativement leur fluorescence diminuer, ce qui signifie qu’ils ont subi de nombreuses divisions. Or, ces lymphocytes ayant fortement proliféré sont entre 20 et 60 % moins nombreux lorsqu’ils ont été activés par des cellules dendritiques préalablement mises en contact avec des particules du VIH, que lorsqu’ils ont été activés par des cellules dendritiques n’ayant croisé la route d’aucun virus. Il est à noter que l’espérance de vie de ces lymphocytes ne semble pas être affectée par ce processus. Le contact avec le VIH diminue donc la capacité des cellules dendritiques à induire la multiplication des lymphocytes T4, ce qui peut expliquer la plus faible efficacité du système immunitaire (Figure 4B – point 1).
… et une efficacité des lymphocytes qui n’est pas au rendez-vous !
Ne s’arrêtant pas en si bon chemin, l’équipe de chercheurs continue la caractérisation des paramètres de l’activation du système immunitaire, en testant les fonctions des lymphocytes T4 activés par des cellules dendritiques ayant fricoté avec le VIH. Après tout, si ces cellules sont très efficaces, cela pourrait suffire, malgré leur faible effectif, à lutter contre le virus !
Ces paramètres ont été testés tout d’abord grâce à une approche de cytométrie en flux. Cette technique consiste à marquer des composants cellulaires grâce à des anticorps conçus pour être spécifiques de ces composants. Ces anticorps sont porteurs de fluorophores, ce qui permet de les détecter en étudiant leur fluorescence. Si l’on détecte de la fluorescence dans une cellule, cela signifie qu’elle possède la molécule ciblée par les anticorps qui ont été utilisés lors de l’expérience (Figure 3). De plus, la quantité de fluorescence permet de quantifier l’expression du composant cellulaire. L’une des élégantes subtilités de cette technique est que les anticorps ne sont pas capables d’entrer dans les cellules en temps normal. Toutefois, des substances perméabilisant la membrane des cellules peuvent permettre à ces anticorps de rentrer dans la cellule, si l’expérimentateur le désire. On comprend donc pourquoi cette méthode est plébiscitée par les spécialistes du système immunitaire : elle permet de faire le choix de ne détecter que les molécules présentes en surface des cellules. Or comme nous l’avons vu, c’est bien la présence de marqueurs activateurs à la surface des lymphocytes T4 qui leur confère certaines de leurs capacités d’activation.
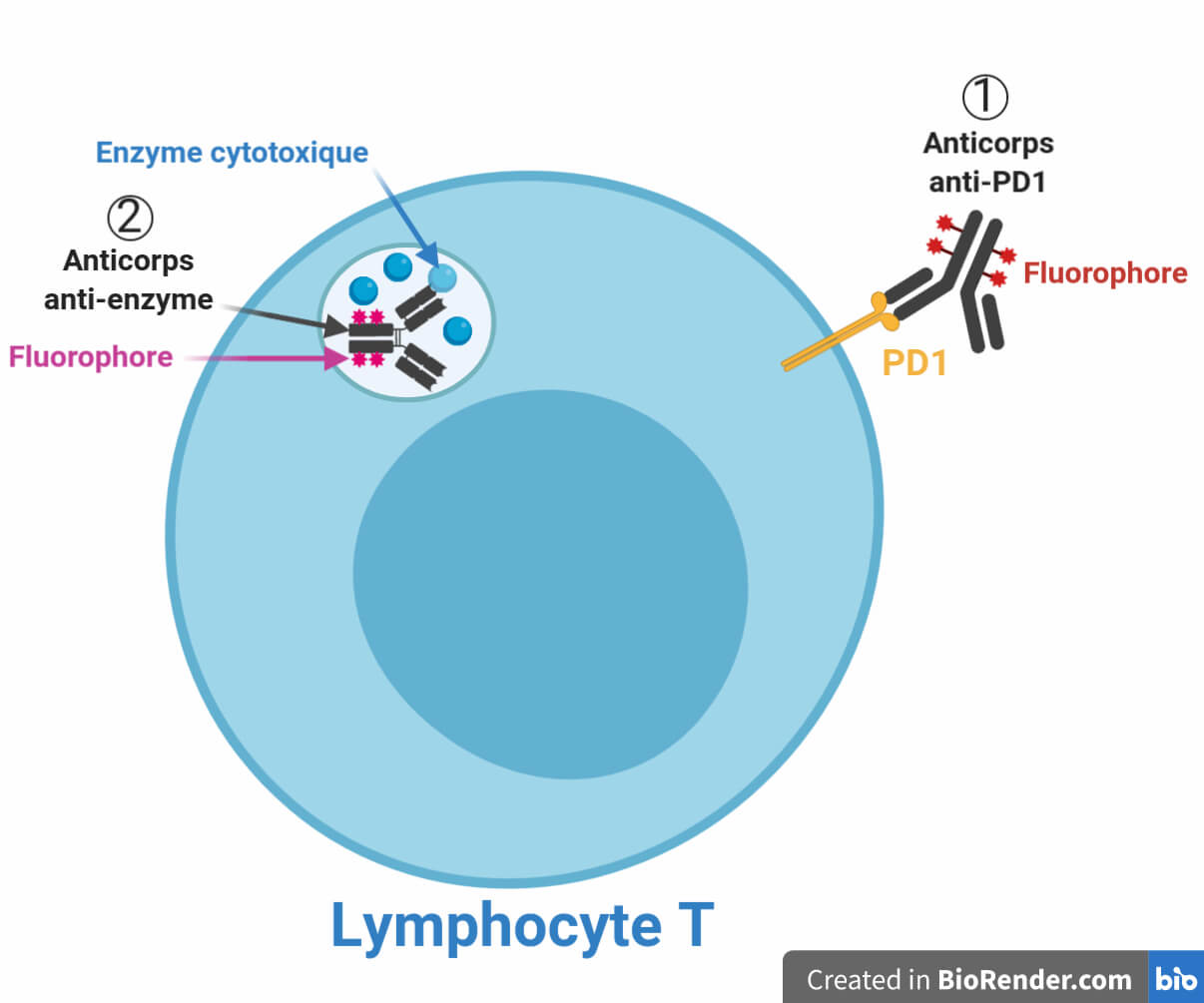
L’équipe a donc cherché à détecter les marqueurs de surface présents sur des lymphocytes T4 activés par des cellules dendritiques préalablement mises en contact avec des particules du VIH. Ils ont observé que ces lymphocytes présentent de nombreuses protéines qui ont une activité inhibitrice sur le système immunitaire, c’est-à-dire qu’elles vont ralentir la réponse immunitaire au lieu de l’activer (Figure 4B – point 2) ! Ces lymphocytes sont 5 à 12 fois plus nombreux à posséder ces marqueurs inhibiteurs à leur surface en comparaison avec des lymphocytes activés par des cellules dendritiques n’ayant pas croisé la route du VIH. Pour certains de ces marqueurs, leur expression est présente dans les deux cas mais est augmentée en présence du VIH, alors que pour d’autres marqueurs, il n’y a d’expression qu’en présence du VIH. Cette information est cruciale, car on sait depuis des études antérieures que les marqueurs inhibiteurs sont plus efficaces que les marqueurs activateurs [4] : une présentation même faible de certains de ces marqueurs suffit à provoquer une inactivation du système immunitaire, même si la cellule possède également des marqueurs activateurs à côté !
Ces données ont été complétées par la quantification de l’expression des gènes concernés via une méthode de RT-PCR (PCR après transcription inverse) quantitative. Il faut toutefois noter encore une fois qu’en immunologie, il est important de savoir quelle est la proportion de cellules qui présente le marqueur étudié, et pas uniquement de déterminer la quantité globale d’expression de ce marqueur. C’est pour cette raison que l’usage de la cytométrie en flux est si important. Au total, sur près de 8 molécules inhibitrices de surfaces testées par cette équipe, 6 voient leur production multipliée par 2 voire 3 lorsque les lymphocytes sont activés par des cellules dendritiques ayant été mises en contact avec le VIH.
Toutes ces données montrent donc que non seulement le VIH réduit la capacité des cellules dendritiques à induire la multiplication les lymphocytes T4, mais qu’en plus, le peu de lymphocytes qui prolifèrent sont porteurs de molécules qui vont inhiber le système immunitaire au lieu de l’activer. Il semblerait donc que l’incursion des saboteurs du VIH au sein du système immunitaire empêche ce dernier de remplir efficacement sa tâche.
Une issue prévisible
Et comme dans un film Hollywoodien cousu de fil blanc, la suite de l’analyse des paramètres d’activation du système immunitaire ne révèle pas de surprise majeure. La quantité de cytokines produites par les lymphocytes T4 activés par des cellules dendritiques ayant été infiltrées par le VIH est diminuée de 30 à 40 % par rapport à une activation par des cellules dendritiques n’ayant pas été en contact avec les particules du VIH (Figure 4B – point 3). Or, ces cytokines étant des molécules d’activation à distance du système immunitaire, on en déduit donc que cette capacité d’activation est inhibée. Ces données ont été obtenues en analysant et en comparant le milieu dans lequel sont cultivés les lymphocytes T4, à l’aide d’anticorps spécifiques de ces cytokines.
Avec la baisse du nombre de lymphocytes T4, la présence de marqueurs inhibiteurs à leur surface ainsi que la baisse de leur production de cytokines activatrices, il y a fort à craindre que l’analyse des lymphocytes T8 ne révèle pas une activité très élevée. Pour déterminer cela, une approche de cytométrie en flux a été adoptée, cette fois-ci en perméabilisant les cellules de manière à détecter les enzymes cytotoxiques présentes à l’intérieur des vésicules des lymphocytes T8 (Figure 3, à gauche). Cette approche montre une importante baisse de la quantité des deux enzymes permettant aux lymphocytes T8 de détruire les cellules infectées, de l’ordre de 30 à 40 % (Figure 4B – point 4). Cela engendre une inhibition de la fonction des lymphocytes T8, en première ligne dans la lutte contre les infections virales comme le VIH de par leur action de lyse des cellules infectées. Cette inhibition est une conséquence de la perte d’efficacité globale des fonctions des lymphocytes T4, dont on a pu voir que tous les paramètres d’activation étaient sabotés par l’action du VIH (Figure 4).
La nécessité d’un Grenelle de l’immunité ?
Cette étude a constitué un jalon majeur dans la compréhension de l’immunodéficience causée par l’infection par le VIH. En effet, elle montre que les particules virales du VIH, capables d’infiltrer les cellules dendritiques, perturbent ainsi l’activation des lymphocytes T4 par ces mêmes cellules dendritiques. Les lymphocytes T4, moins nombreux et moins efficaces (au contact comme à distance), ne parviennent pas à coordonner le reste de l’arsenal immunitaire, lymphocytes T8 en tête.
Le principal défaut de cette étude est d’être réalisée exclusivement in vitro, impliquant des cellules dendritiques activées artificiellement, des particules virales ne reflétant pas la diversité des virions présents lors d’une réelle infection ou encore des conditions de contact entre virions et cellules dont on ne peut pas certifier qu’elles correspondent à ce qui a lieu in vivo. Mais en gardant toutes ces limites à l’esprit, l’importance de cette étude résidait à l’époque de sa parution dans sa cohérence avec les observations réalisées sur des cellules immunitaires de patients SIDA. Elle a depuis permis d’orienter de nombreuses études in vivo qui ont confirmé ce mécanisme [5].
À l’image des Aliens d’Independence Day, l’immunité paie cher la rigueur de son organisation, dont l’acteur central est le lymphocyte T4, dûment activé par une cellule dendritique. Cette centralisation du rôle de coordination par ces cellules, qui est à l’origine de l’efficacité du système immunitaire et de la relative facilité avec laquelle on peut l’exploiter — notamment par le biais de la vaccination — est aussi son point faible. Une fois que ce maillon a cédé, c’est en effet l’intégralité de la chaîne qui s’effondre inexorablement, comme cela est malheureusement le cas des patients infectés par le VIH.
Alors que faire ? Est-il possible d’utiliser ces données pour envisager des thérapies contre le SIDA ? C’est ce qui a été entrepris, notamment sur la base de cette étude de 2011, en essayant de bloquer les fameux marqueurs inhibiteurs situés à la surface des lymphocytes T4 activés par des cellules dendritiques sabotées par le VIH. Ces thérapies ciblent notamment la protéine PD-1, inhibiteur majeur de l’action des lymphocytes T4 et dont le rôle dans la dépression immunitaire est bien connu [1]. La compréhension de ce dysfonctionnement peut nous permettre d’envisager de réformer l’administration immunitaire, de manière à l’immuniser contre ce genre d’action. Et ainsi espérer, peut-être, sur le long terme, d’entrevoir le jour de notre indépendance vis-à-vis du SIDA.
[*] SIDA : le Syndrome d’ImmunoDéficience Acquise est le nom donné à la dernière phase de l’infection d’un patient humain par le Virus de l’Immunodéficience Humaine (VIH). Cette phase est caractérisée par une immunodéficience, c’est-à-dire l’incapacité du système immunitaire à fonctionner correctement et à défendre l’organisme contre les agents infectieux et les dangers internes (cancer notamment). L’immunodéficience est dans ce cas la conséquence de l’infection par le VIH, qui va empêcher le bon fonctionnement du système immunitaire de plusieurs façons.
[1] Day C. L., et al., PD-1 expression on HIV-specific T cells is associated with T-cell exhaustion and disease progression. Nature, 2006. DOI : 10.1038/nature05115. [Publication scientifique]
[2] Weiss L., et al., Human immunodeficiency virus-driven expansion of CD4+CD25+ Tregs, which suppress HIV-specific CD4 T-cell responses in HIV-infected patients. Blood, 2004. DOI : 10.1182/blood-2004-01-0365. [Publication scientifique]
[3] Karlhans F. C., et al., HIV-1 Impairs in Vitro Priming of naïve T Cells and Gives Rise to Contact-Dependent Suppressor T Cells. Eur. J. Immunol, 2010. DOI : 10.1002/eji.201040377. [Publication scientifique]
[4] Brunner M. C., et al., CTLA-4-Mediated inhibition of early events of T cell proliferation. J. Immunol., 1999. [Publication scientifique]
[5] Mylvaganam G. H., et al., Combination anti-PD-1 and antiretroviral therapy provides therapeutic benefit against SIV. JCI Insight, 2018. DOI : 10.1172/jci.insight.122940. [Publication scientifique]