Ce papier-mâché a été écrit par des étudiantes et étudiants de Master 1 du Magistère Européen de Génétique de l’Université Paris-Cité, dans le cadre d’une collaboration pédagogique pour l’UE Communication scientifique.
Promotion 2023-2024
Écriture : Gaëlle Alleon, Louise Lecordier, Marilou Scravaglieri et Marco Martins Gama
Relecture scientifique : Équipe pédagogique : Sandra Claret et Alain Zider
Relecture de forme : Jérémy Ferrand
Temps de lecture : environ 10 minutes.
Thématiques : Génétique, Développement (Biologie)
Publication originale : Fukaya T., Dynamic regulation of anterior-posterior patterning genes in living Drosophila embryos. Current Biology, 2021. DOI : 10.1016/j.cub.2021.02.050

Et si on vous disait que le développement d’un embryon semble laisser un peu de place au hasard ? Effrayant ? Pourtant, vous n’avez pas six bras ! Chez la mouche comme chez l’humain, tout commence avec un procédé aléatoire. Découvrez comment les gènes s’orchestrent peu à peu comme une grande symphonie.
Tout commence par un zygote, issu de la fusion entre un gamète mâle (spermatozoïde) et un gamète femelle (ovocyte). À l’aube de son développement embryonnaire, le nouvel individu se compose de cette unique cellule. Par la suite, elle se divise en deux cellules-filles qui donneront à leur tour naissance à de nombreuses cellules identiques. Il est cependant évident que les cellules adoptent toutes plus tard des destins différents en devenant des cellules de la tête, des bras, etc. Chacune emprunte donc son chemin afin d’acquérir une identité qui lui est propre.
Pour étudier ce phénomène d’acquisition de l’identité, la drosophile, cette drôle de mouche qui nous envahit l’été, est un organisme modèle particulièrement intéressant pour les scientifiques. En effet, la drosophile est souvent utilisée en laboratoire pour étudier différents phénomènes biologiques, mais pour quelles raisons ?
La drosophile, une drôle de petite bête !
La drosophile a permis un grand nombre de découvertes historiques telles que l’hérédité chromosomique et la liaison génétique, via les travaux de Thomas Morgan, ou encore de comprendre le rôle de nombreux gènes dans le développement embryonnaire [1]. Elle possède également beaucoup d’avantages pratiques. D’abord, sa petite taille permet de stocker un grand nombre d’individus en prenant très peu place. De plus, son temps de développement est très court : environ 10 jours à 25°C pour atteindre le stade adulte. Beaucoup d’outils génétiques ont été développés au fil du temps et la plupart des mécanismes biologiques étudiés sont en partie conservés (c’est-à-dire identiques) chez l’humain.
La question de l’acquisition d’une identité cellulaire propre est très étudiée. Jusqu’ici, la recherche a mis en évidence un élément essentiel à ce phénomène : les ARN messagers. Ce sont des transcrits produits à partir d’ADN au cours d’un procédé appelé la transcription, et ils permettent la production de protéines au cours de la traduction. Tout l’ADN n’est pas transcrit puis traduit en protéines, seulement certaines portions le sont, on les nomme gènes et on dit qu’ils sont exprimés. On sait aujourd’hui que les cellules acquièrent leur identité en fonction des gènes qu’elles expriment. Chez la drosophile, un exemple connu est celui du gène hunchback : au début du développement, il est très exprimé dans les noyaux à l’avant de l’embryon, mais pas à l’arrière (Figure 1). Ce motif d’expression permet aux futures cellules de l’avant d’acquérir une identité antérieure, et à celles de l’arrière une identité postérieure [2]. Nos cellules auparavant identiques empruntent déjà deux chemins différents.
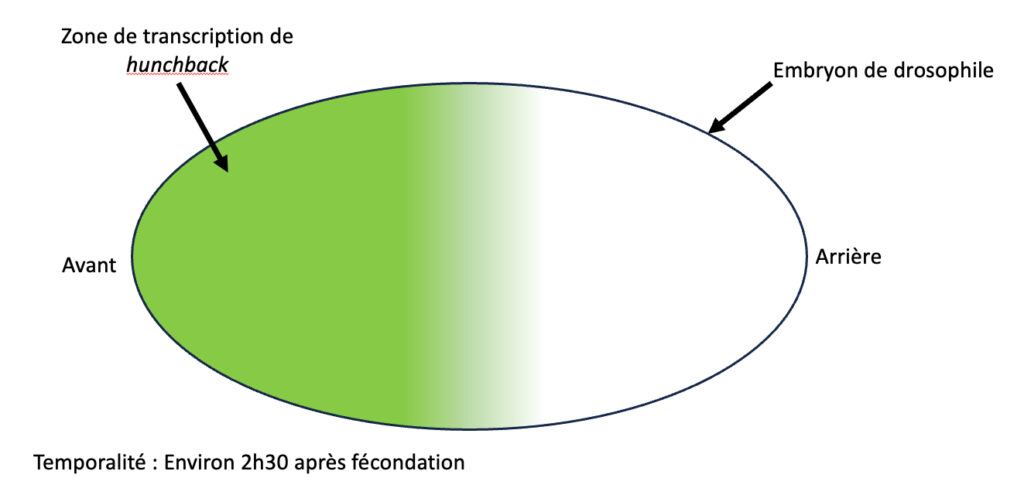
Ce n’est qu’un exemple parmi des milliers d’autres gènes dont les motifs d’expressions peuvent vite devenir très complexes. Le développement étant si important, on pensait jusque là que son déroulement était très contrôlé dès le début. L’activation des gènes devrait se faire au bon endroit et au bon moment à l’image du gène hunchback. Mais si on vous disait qu’il a récemment été découvert que le développement contient des phases dont l’expression des gènes semble complètement aléatoire ? Rassurez-vous, aucun risque de développer six bras. Comme un orchestre qui s’accorde afin de mieux jouer, l’apparent chaos de l’activation des gènes révèle un ordre permettant le bon agencement de l’embryon.
L’illusion du désordre
Dans ses travaux, Takashi Fukaya parvient à montrer que tout n’est pas aussi millimétré que ce qu’on pensait dans l’embryon. Il a utilisé une méthode permettant de capturer le moment où le gène hunchback est exprimé, en marquant par fluorescence la présence des transcrits de celui-ci dans chaque noyau embryonnaire [voir Pour approfondir]. Ainsi, quand hunchback est transcrit, le noyau « s’allume » en vert. D’après ce qu’on a vu sur l’expression de hunchback, on s’attendrait à voir tout l’avant de l’embryon fluorescer en vert (Figure 1). Mais au lieu de ça, l’auteur de la publication a vu les noyaux clignoter de façon désynchronisée, et à un rythme qui semblait complètement aléatoire même lorsqu’ils étaient situés à l’avant de l’embryon (vidéo disponible ici : Vidéo S1).
C’est comme si chaque noyau vaquait à ses occupations, individuellement, au lieu de coopérer. On peut les comparer à des musiciens essayant chacun de jouer sa partie dans le morceau intitulé « L’expression de hunchback dans l’embryon ». Les gènes ne sont donc pas tout le temps actifs, et ne sont pas exprimés de manière coordonnée entre les noyaux. Nous l’avons pourtant vu : il faut bien que tout cela soit ordonné à la fois dans le temps et l’espace pour permettre un développement harmonieux et donc un organisme viable. Comment comprendre le chaos qu’on a vu, quand on sait que tout doit être contrôlé avec précision ?
À chacun son tempo
Dans le développement comme en musique, le tempo a son importance ! Pour savoir à quel moment et pendant combien de temps les gènes s’activent dans les noyaux embryonnaires de drosophiles, Takashi Fukaya les a filmés et observés ! Il a ainsi mis en évidence que dans certains noyaux, hunchback s’exprime fréquemment et longtemps, un peu comme un violoniste ou un flûtiste jouant frénétiquement sa partition (Figure 2). C’était surtout le cas dans les noyaux à l’avant de l’embryon. Et c’est parfaitement cohérent, car on sait que c’est là qu’hunchback est le plus exprimé (Figure 1) !
Dans d’autres noyaux en revanche, ce même gène s’exprime moins longtemps et seulement une fois de temps en temps ; ceux-ci nous font davantage penser aux joueurs de tuba ou aux percussionnistes… (Figure 3) C’était notamment le cas dans des noyaux situés vers l’arrière de l’embryon. Une fois encore, cela est cohérent puisqu’à l’arrière, hunchback n’est normalement pas exprimé.
De la même manière qu’il existe une multitude d’instruments jouant à des temps distincts, hunchback est activé plus ou moins longtemps en fonction des noyaux. On peut même ajouter qu’il existe un continuum de rythmes d’activation, qui permettent de passer progressivement d’un rythme soutenu à l’avant, vers un rythme plus saccadé à l’arrière de l’embryon. On pourrait associer ces rythmes à autant d’instruments ! Si tout cela semblait désordonné à l’échelle de l’embryon, c’était surtout parce que l’expression n’était pas synchronisée entre les cellules. Finalement, les instruments ne sont pas en chœur, mais peuvent jouer à des rythmes similaires. On a donc vers l’avant des violons ou des flûtes, et vers l’arrière des tubas ou des percussions. Mais qui leur dicte quand et comment jouer ?
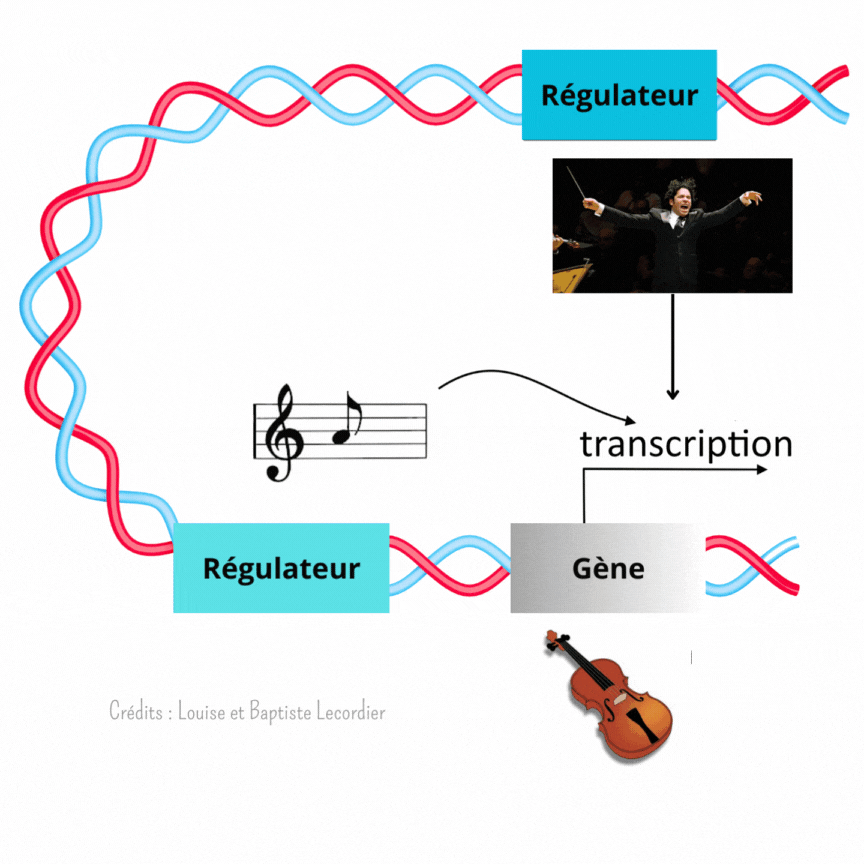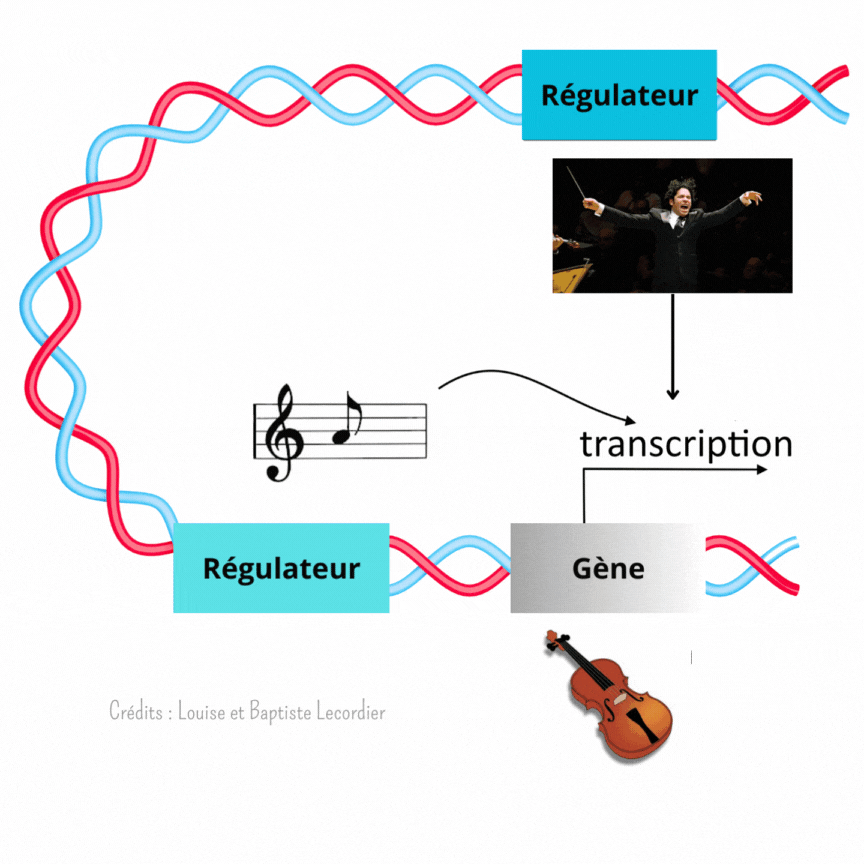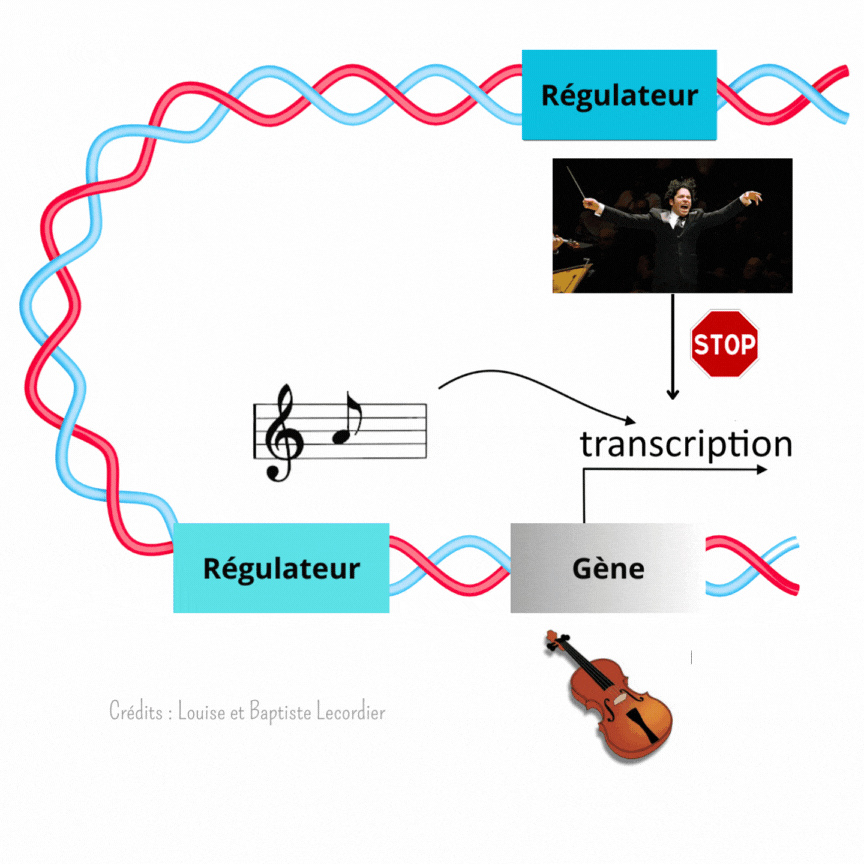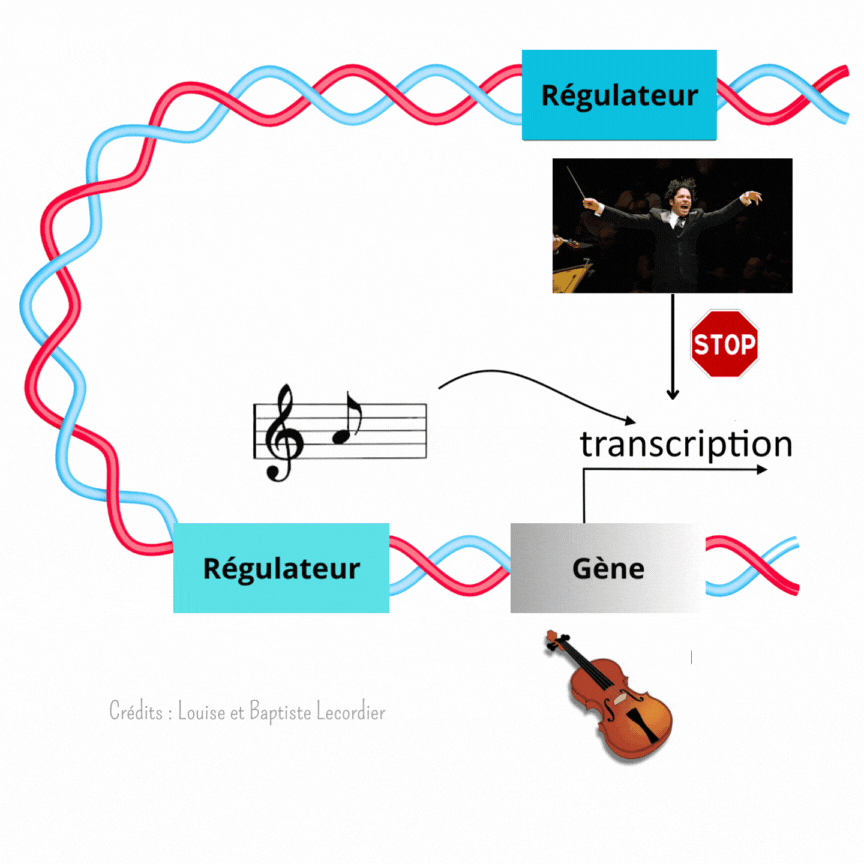
Partition vs chef d’orchestre
C’est là que les éléments régulateurs du gène entrent en scène. Ils permettent de lui donner la nuance et le tempo à suivre. Ces éléments sont directement présents sur la séquence ADN, plus ou moins loin du gène.
L’activation des gènes est modulée à plusieurs niveaux [3] (Figure 4) : c’est là qu’intervient Gustavo, notre chef d’orchestre, qui est un élément éloigné du gène, et la partition, qui est un élément proche du gène. Celle-ci indique qu’il faut jouer, et quelle note jouer, tandis que Gustavo interfère avec elle en faisant taire l’instrument plus ou moins fréquemment. Il arrêtera le tuba plus souvent, tandis qu’il laissera le violon jouer de façon plus continue. Il apporte un niveau de régulation supplémentaire au gène. L’auteur de la publication a mis en évidence cette interférence en enlevant Gustavo. Sans cet élément, les noyaux tuba/percussion jouent comme des noyaux violons : la transcription est devenue plus longue et moins saccadée, car moins interrompue.
Remarquable n’est-pas ?! Cette manière dont dialoguent les éléments régulateurs pour coordonner le développement embryonnaire. Les partitions sont importantes pour chaque instrument (ici chaque cellule), mais parfois, elles ne suffisent pas. Les musiciens ont bien souvent besoin d’un chef d’orchestre pour les guider. C’est la même chose pour les noyaux du syncytium embryonnaire : pour que le développement s’effectue correctement, leurs gènes doivent être activés au bon moment et au bon endroit.
Concerto pour Droso
Ainsi, le développement n’est pas réglé comme une horloge. Fukaya montre précisément qu’au début, tout semble chaotique avec une transcription des gènes discontinue et aléatoire. Pourtant, en regardant de plus près, il a mis en évidence que l’activité des gènes suit en réalité un certain rythme selon les noyaux, comme des instruments différents dans un orchestre (Figure 5). La transcription est soit fréquente et prolongée comme le jeu d’un violon, soit rare et courte comme les percussions. Pour diriger cette symphonie, les éléments régulateurs proches des gènes (partition) et éloignés des gènes (chef d’orchestre) travaillent de concert lors du développement embryonnaire. Les partitions indiquent quand jouer, tandis que les chefs d’orchestre interfèrent avec la partition pour créer un modèle harmonieux.
Précisons tout de même que cette image a ses limites : contrairement au chef d’orchestre qui peut indiquer s’il faut jouer fort ou non, les éléments régulateurs ne peuvent pas agir sur l’intensité de chaque activation mais seulement sur leur longueur et leur rythme.
De manière plus générale, cette découverte change la vision que nous avions sur la régulation de l’expression des gènes au cours du développement. Avant, il semblait logique de penser que c’était l’activation plus ou moins forte d’un gène qui conférait une identité au noyau puis à la cellule. Or cette étude révèle que le niveau d’expression d’un gène ne change pas, c’est le rythme de transcription qui compte. Ce dernier est régulé par le chef d’orchestre qui indique aux gènes quand s’activer mais aussi quand s’arrêter, un peu comme s’il avait le pouvoir de plus ou moins ouvrir le robinet, au rythme souhaité. Et il réalise cette régulation de manière plus ou moins forte en fonction du noyau. C’est en fait ce rythme, à la fois stochastique (= aléatoire) et guidé, qui aboutit à la formation d’identités cellulaires distinctes.
Dans ce contexte, il est intéressant de noter que depuis, certains mécanismes de régulation de l’expression impliquant ce phénomène de transcription rythmée ont été découverts. Dans un article postérieur, Fukaya a montré avec Hamamoto que lorsqu’il avait lieu dans certaines régions non-codantes du génome, ce mode de transcription pouvait réguler l’expression de gènes voisins. Si le rythme est rapide dans la région non-codante, le gène n’a pas le temps d’être transcrit de son côté. Au contraire, si le tempo ralenti dans la région non-codante, cette fois-ci les gènes voisins peuvent être transcrits puis exprimés [4].
Éléments pour approfondir
Vous avez dit des noyaux qui clignotent ? C’est bien joli de voir des noyaux s’allumer en une couleur ou une autre, mais comment s’y prend-on au juste ? Et comment est-on sûr que ce signal signifie bien qu’un gène est transcrit ? Voyons cela un peu plus en détail.
Dans un noyau cellulaire, beaucoup de gènes sont transcrits en même temps. Même si l’on pouvait observer cela avec le meilleur des microscopes, il serait laborieux de voir si LE gène auquel on s’intéresse est bien transcrit parmi tous les gènes exprimés. La méthode pour le voir est de rendre son transcrit visible par fluorescence, un peu comme si on lui faisait enfiler un gilet jaune. De cette manière, impossible de le manquer parmi les autres transcrits.
Alors comment met-on un gilet jaune à un transcrit ? C’est un peu plus délicat que pour les cyclistes. Ici, l’idée est de partir du gène, et de le modifier un peu. À la fin de la séquence du gène, Fukaya insère ce qu’on appelle un tag (une étiquette), nommé MS2, qui est capable de former une structure particulière en tige-boucle au niveau de l’ARN messager. Donc quand le gène est transcrit, le transcrit porte les informations liées aux gènes, mais aussi cette étiquette en tige-boucle. En parallèle, on fait exprimer une protéine dite de fusion qui contient : du MCP (MS2 coat protein) capable de se fixer sur notre tag MS2 accolé au transcrit qui nous intéresse, et la GFP (green fluorescent protein) qui est fluorescente, notre gilet jaune en somme, ou plutôt ici…notre gilet vert (Figure 6).
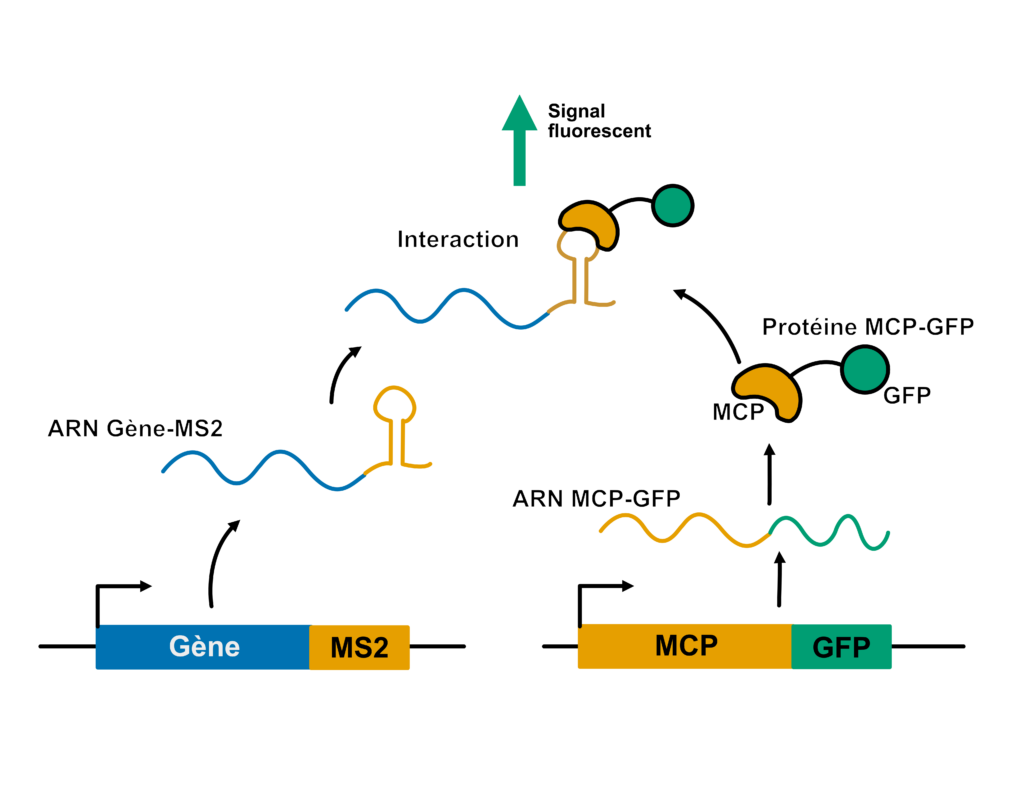
Il suffit ensuite de regarder l’échantillon à l’aide d’un microscope à fluorescence. Si le gène qui nous intéresse est exprimé dans un noyau, son ARN nouvellement formé va immédiatement être reconnu par MCP-GFP et on voit alors le noyau se colorer en vert.
[1] Tolwinski N.S., Introduction: Drosophila-A Model System for Developmental Biology. J Dev Biol, 2017. DOI : 10.3390/jdb5030009. [Review]
[2] Staller M.V., et al., Shadow enhancers enable Hunchback bifunctionality in the Drosophila embryo. PNAS, 2015. DOI : 10.1073/pnas.1413877112. [Publication scientifique]
[3] Barolo S., Shadow enhancers: frequently asked questions about distributed cis-regulatory information and enhancer redundancy. Bioessays, 2012. DOI : 10.1002/bies.201100121. [Review]
[4] Hamamoto K., et al., Dynamic Interplay between Non-Coding Enhancer Transcription and Gene Activity in Development. Nature Communications, 2023. DOI : 10.1038/s41467-023-36485-1. [Publication scientifique]

Bravo pour cet article, et pour Papier-Mâché.
Je voualis signaler que cet article contient cependant une inexactitude qu’il serait bon de corriger.
Au stade où il est étudié dans les article cités, l’embryon de drosophile est une unique cellule muti-nuclée. Les descriptions faites ici se rapportent donc en fait à des noyaux individuels, et non à des cellules.
Bonjour Geneviève, merci pour votre message. Le groupe d’étudiantes et étudiant a modifié le texte pour prendre en compte votre remarque, j’espère que cela vous conviendra.